《
体外诊断试剂注册管理办法》明确规定, 注册证及附件载明内容中发生发生进口体外诊断试剂生产地址变更的,申请人应当向原注册部门申请许可事项变更。
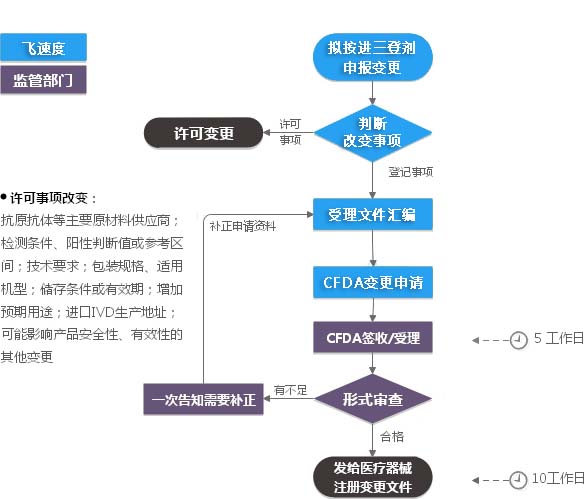
进口三类IVD注册证申请变更(许可事项变更),需填写进口体外诊断试剂注册变更申请表。办理进口三类体外诊断试剂注册变更,需向药监总局相关部门申请、携带相关文件。
《进口IVD注册变更申请表》可变更的许可事项类型有
1、变更抗原、抗体等主要材料的供应商;
2、变更检测条件、阳性判断值或参考区间;
3、变更产品储存条件和/或有效期;
4、修改产品技术要求,但不降低产品有效性的变更;
5、进口体外诊断试剂生产地址的变更;
6、对产品说明书和/或产品技术要求中文字的修改,但不涉及技术内容的更改;
7、变更包装规格;
8、变更适用机型;
9、增加临床适应症;
10、增加临床测定用样本类型的变更;
11、其他可能影响产品有效性的变更。
除了进口IVD注册变更申请表,还要附材料
1、注册人关于变更情况的声明
2、原
医疗器械注册证及其附件复印件
3、历次医疗器械注册变更文件复印件
4、具体变更情况的其他技术资料要求
(1)变更抗原、抗体等主要材料的供应商相应资料;
(2)变更检测条件、阳性判断值或参考区间相应资料;
(3)变更产品储存条件和/或有效期相应资料;
(4)修改产品技术要求,但不降低产品有效性的变更相应资料;
(5)进口体外诊断试剂生产地址的变更相应资料;
(6)对产品说明书和/或产品技术要求中文字的修改,但不涉及技术内容的更改相应资料;
(7)变更包装规格相应资料;
(8)变更适用机型相应资料;
(9)增加临床适应症相应资料;
(10)增加临床测定用样本类型的变更相应资料;
(11)其他可能影响产品有效性的变更相应资料;
应当根据产品具体变更情况,提交该变更对产品性能可能产生的影响进行验证的试验资料(如涉及)。
5、境外申请人注册地或生产地址所在国家(地区)主管部门出具的批准变更的证明文件
6、境外申请人在中国境内指定代理人的委托书
7、代理人承诺书
8、代理人营业执照副本或者机构登记证明复印件
9、符合性声明和符合标准的清单
10、申请人所在地公证机构出具的关于英文/原文资料公证件