24小时服务热线:19103801095
医疗器械注册人制度咨询,如有需求,您可以联系在线客服人员。很乐意为您服务!
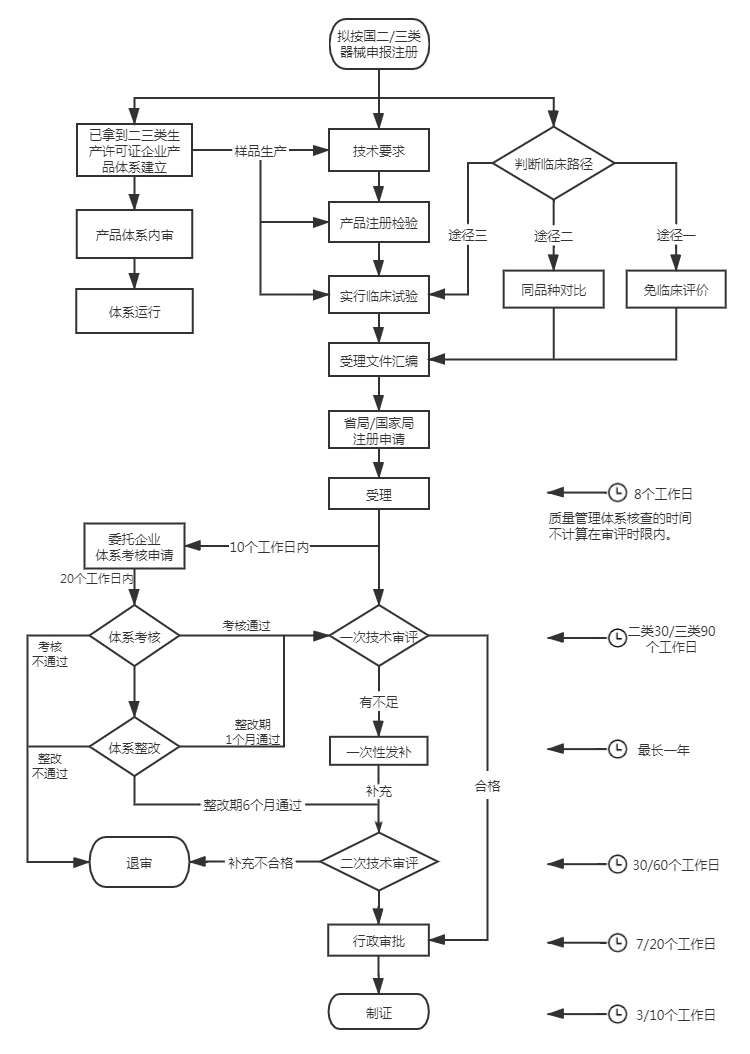
| 主管部门 | 管理类别 | 首次注册 | 注册变更 (许可事项变更) |
延续注册 (五年一次) |
相关文件 | 实施日期 | ||
|---|---|---|---|---|---|---|---|---|
| 省 局 |
1 | 福建省 | Ⅱ | 5.77 | 2.42 | 2.39 | 闽价费〔2018〕187号 | 2018/9/11 |
| 2 | 江西省 | Ⅱ | 5.467 | 2.289 | 2.268 | 赣发改收费[2020]73号 | 2020/2/6 | |
| 3 | 上海市 | Ⅱ | 6.573 | 2.751 | 2.73 | 工信部联企业[2011]300号 | 2018/5/9 | |
| 4 | 海南省 | Ⅱ | 5.81 | 2.408 | 2.387 | 琼发改收费〔2020〕351号 | 2020/5/27 | |
| 5 | 山东省 | Ⅱ | 5.754 | 2.408 | 2.387 | 鲁发改成本〔2020〕949号 | 2020/08/21 | |
| 6 | 安徽省 | Ⅱ | 5.005 | 2.093 | 2.079 | 皖发改价费函〔2019〕361号 | 2019/10/22 | |
| 7 | 浙江省 | Ⅱ | 6.573 | 2.2008 | 2.184 | 省疫情防控〔2020〕24号 | 2020/7/1至2020/12/31 | |
| 8 | 山西省 | Ⅱ | 4.2315 | 1.6275 | 1.6275 | 晋发改收费函〔2020〕86号 | 2020/4/16 | |
| 9 | 云南省 | Ⅱ | 4.28 | 1.75 | 1.75 | 云价收费函〔2018〕17号 | 2018/3/16 | |
| 10 | 河北省 | Ⅱ | 7.23 | 3.03 | 3 | 冀价费函〔2016〕210号 | 2016/10/1 | |
| 11 | 江苏省 | Ⅱ | 5.915 | 2.471 | 2.457 | 苏发改收管发[2019]91号 | 2019/2/13 | |
| 12 | 宁夏 | Ⅱ | 1.5 | 0.65 | 0.65 | 宁药监〔2019〕29号 | 2019/12/18 | |
| 13 | 黑龙江 | Ⅱ | 5.76 | 2.416 | 2.4 | 黑政办规〔2017〕33号 | 2017/8/1 | |
| 14 | 广东省 | Ⅱ | 5.726 | 2.394 | 2.38 | 粤发改价格函〔2019〕666号 | 2019/2/25 | |
| 15 | 湖南省 | Ⅱ | 5.04 | 2.114 | 2.1 | 湘发改价费〔2019〕224号 | 2019/4/11 | |
| 16 | 四川省 | Ⅱ | 3.95 | 1.65 | 1.65 | 川发改价格〔2019〕491号 | 2019/11/27 | |
| 17 | 贵州省 | Ⅱ | 4.29 | 1.76 | 1.76 | 黔发改收费〔2017〕1589号 | 2017/10/17 | |
| 18 | 广西 | Ⅱ | 7.57 | 3.16 | 3.14 | 桂价医函〔2017〕536号 | 2017/12/29 | |
| 19 | 辽宁省 | Ⅱ | 5 | 2.1 | 2.1 | 辽发改收费〔2020〕299号 | 2020/6/12 | |
| 20 | 吉林省 | Ⅱ | 0 | 0 | 0 | 吉政发〔2020〕4号 | 2020/2/8 | |
| 21 | 湖北省 | Ⅱ | 0 | 0 | 0 | |||
| 22 | 河南省 | Ⅱ | 0 | 0 | 0 | |||
| 23 | 重庆市 | Ⅱ | 0 | 0 | 0 | 渝府办发〔2019〕56号 | 2019/5/15 | |
| 24 | 甘肃省 | Ⅱ | 0 | 0 | 0 | |||
| 25 | 新疆 | Ⅱ | 0 | 0 | 0 | |||
| 26 | 内蒙古 | Ⅱ | 0 | 0 | 0 | 内发改费字〔2019〕773号 | 2019/9/17 | |
| 27 | 北京市 | Ⅱ | 0 | 0 | 0 | 京发改[2019]569号 | 2019/4/25 | |
| 28 | 天津市 | Ⅱ | 0 | 0 | 0 | 天津发改委 | 2019/1/4 | |
| 29 | 陕西省 | Ⅱ | 0 | 0 | 0 | 陕yjj/2020-00009 | 2020/1/10 | |
| 主管部门 | 管理类别 | 首次注册 | 变更注册 (许可事项变更) |
延续注册 (五年一次) |
临床试验申请费 (高风险医疗器械) |
相关文件 | 实施日期 | ||
|---|---|---|---|---|---|---|---|---|---|
| 国家局 | 境内 | Ⅲ | 15.36 | 5.04 | 4.08 | 4.32 | 局令15年53号 | 2015/5/27 | |
| 文件名称 | 文号 |
|---|---|
| 关于扩大医疗器械注册人制度试点工作的通知 | 国药监械注〔2019〕33号 |
| 关于实施《湖南省医疗器械注册人制度试点工作实施方案》的通知 | 湘药监发〔2019〕29号 |
| 福建省医疗器械注册人制度试点工作实施方案 | |
| 《长江三角洲区域医疗器械注册人制度试点工作实施方案》政策解读 | |
| 山东省药品监督管理局关于印发《山东省医疗器械注册人制度试点工作实施方案》的通知 | 鲁药监注〔2019〕58号 |
| 广西壮族自治区药品监督管理局关于印发广西医疗器械注册人制度试点工作实施方案的通知 | |
|
辽宁省药品监督管理局公开征求《辽宁省医疗器械注册人制度试点工作实施方案》意见 |
|
| 河北省药品监督管理局关于印发《河北省医疗器械注册人制度试点工作实施方案》的通知 | |
| 黑龙江省药品监督管理局关于印发《黑龙江省医疗器械注册人制度试点工作实施方案(试行)》的通知 | 黑药监规〔2019〕9号 |
| ...... | ...... |
| 二类医疗器械注册人制度咨询 | 三类医疗器械注册人制度咨询 |
| 委托生产企业寻找 |