《
医疗器械监督管理条例》(650号文件)十五条:
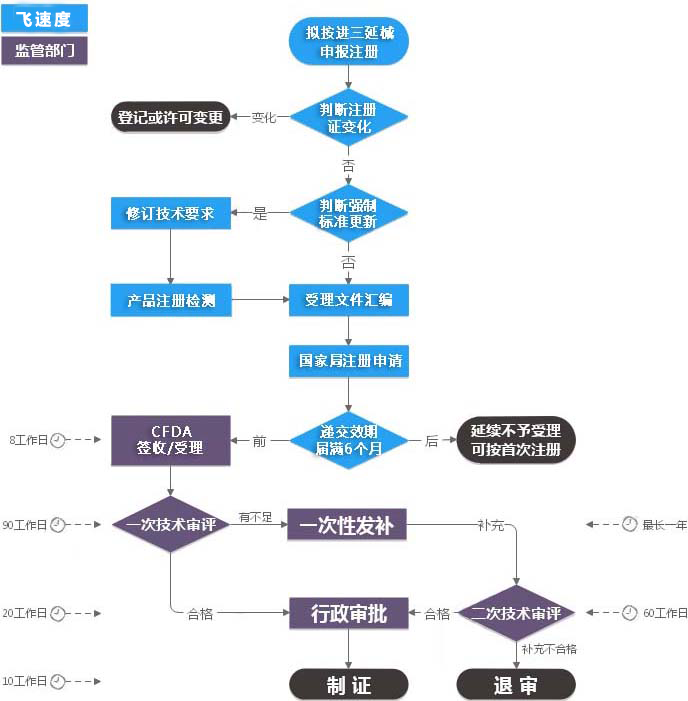
医疗器械注册证有效期为5年。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提出延续注册的申请。通常情况下,三类注册证延续飞速度将提前一年时间递交申请,延续注册因发补资料等问题常在6个月内无法正常拿证,故提前一年续证。
申请人应为境外依法进行登记的生产企业,且该医疗器械已在注册申请人注册地或者生产地址所在国家(地区)已获准上市销售。
不让延续注册的情形有哪些?
1、注册人未在规定时限内提出延续注册申请的;
2、医疗器械强制性标准已经修改,该医疗器械不能达到新要求的;
3、对用于治疗罕见疾病以及应对突发公共卫生事件急需的医疗器械,批准注册部门在批准上市时提出要求,注册人未在规定期限内完成医疗器械注册证载明事项的。
延续注册申报资料
1、申请表;
2、证明性文件;
境外注册人应当提交其在中国指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
注:进口医疗器械延续注册时,不需要提供注册人注册地或者生产地址所在国家(地区)批准产品上市销售的证明文件。
3、关于产品没有变化的声明:注册人提供产品没有变化的声明。
4、原医疗器械注册证及其附件的复印件、历次医疗器械注册变更文件复印件。
5、注册证有效期内产品分析报告
(1)产品临床应用情况,用户投诉情况及采取的措施。
(2)医疗器械不良事件汇总分析评价报告,报告应对本产品上市后发生的可疑不良事件列表、说明在每一种情况下生产企业采取的处理和解决方案。对上述不良事件进行分析评价,阐明不良事件发生的原因并对其安全性、有效性的影响予以说明。
(3)产品市场情况说明。
(4)产品监督抽验情况(如有)。
(5)如上市后发生了召回,应当说明召回原因、过程和处理结果。
(6)原医疗器械注册证中载明要求继续完成工作的,应当提供相关总结报告,并附相应资料。
6、产品检验报告
如医疗器械强制性标准已经修订,应提供产品能够达到新要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合强制性标准实施通知规定的检验报告。其中,委托检验报告应由具有医疗器械检验资质的医疗器械检验机构出具。
7、符合性声明
(1)注册人声明本产品符合《
医疗器械注册管理办法》和相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
(2)所提交资料真实性的自我保证声明(进口产品由注册人和代理人分别出具)。
8、其他
如在原医疗器械注册证有效期内发生了涉及产品技术要求变更的,应当提交依据注册变更文件修改的产品技术要求一式两份。
申报表应附资料
1、注册人关于产品没有变化的声明;
2、原医疗器械注册证机器附件复印件;
3、历次医疗器械注册变更文件复印件;
4、注册证有效期内产品分析报告;
(1)产品临床应用情况,用户投诉情况及采取的措施。
(2)医疗器械不良事件汇总分析评价报告,报告应对本产品上市后发生的可疑不良事件列表、说明在每一种情况下生产企业采取的处理和解决方案。对上述不良事件进行分析评价,阐明不良事件发生的原因并对其安全性、有效性的影响予以说明。
(3)产品市场情况说明。
(4)产品监督抽验情况(如有)。
(5)如上市后发生了召回,应当说明召回原因、过程和处理结果。
(6)原医疗器械注册证中载明要求继续完成工作的,应当提供相关总结报告,并附相应资料。
5、注册证有效期内发生涉及产品技术要求变更的,提交根据变更文件修改的产品说明书和/或产品技术要求各一式两份;
(1)产品型号/规格及其划分说明。
(2)性能指标。
(3)检验方法。
(4)附录。
6、产品检验报告;
如医疗器械强制性标准已经修订,应提供产品能够达到新要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合强制性标准实施通知规定的检验报告。其中,委托检验报告应由具有医疗器械检验资质的医疗器械检验机构出具。
7、境外注册人在中国境内指定代理人的委托书;
8、代理人承诺书;
9、代理人营业执照副本或者机构登记证明复印件;
10、符合性声明和符合标准的清单;
11、申请人所在地公证机构出具的公证件。