24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

医用口罩产品注册技术审查指导原则
本指导原则旨在指导和规范医用口罩产品的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术
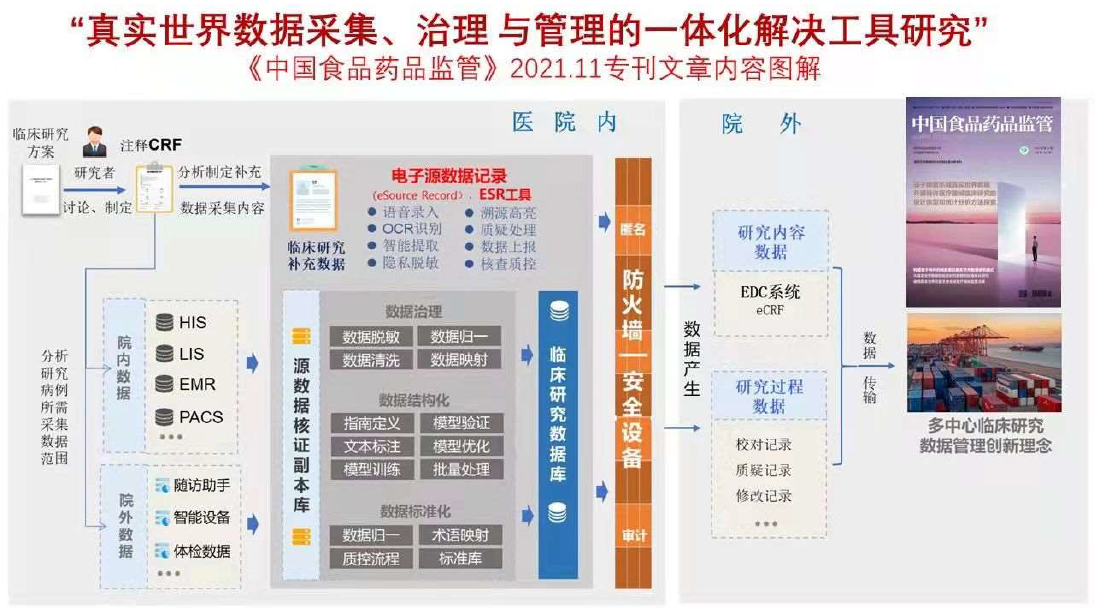
一千个人眼里有一千个哈姆雷特,这句莎士比亚的名言,或许也适用于近年临床研究领域当仁不让的热词之一——真实世界研究(RWS)。毕竟,RWS并非严格的概念定义,而是与
查看详情
2021年4月13日,为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,国家药品监督管理局药品审评中心组织制定了《用于产生真实世界证据的真实世界数据指导原则(试行)》,并与即日发布。
查看详情
医疗器械注册体系现场核查结论有通过核查、现场复核、未通过核查等结论,如何进行判定?资料整改和现场复核的方式判定依据是什么?且听官方答疑。
查看详情
目录规定了“豁免情况不包括新材料、新作用机理、新功能”的产品。新材料、新作用机理、新功能仅指没有在国内已上市同类输注器具中使用过的材料、作用机理和
查看详情
视力筛查仪注册技术审查指导原则 本指导原则旨在指导注册申请人对视力筛查仪产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指
查看详情
决策是否开展医疗器械临床试验 技术指导原则 决策是否开展医疗器械临床试验是综合考虑产品的适用范围、技术特征、生物学特性、风险程度及已有研究数据(包括临床
查看详情
医疗器械注册申报临床评价报告技术指导原则
一、前言 医疗器械临床评价是采用科学合理的方法对临床数据进行评价、分析,以确认医疗器械在其适用范围下的安全性、临床