24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
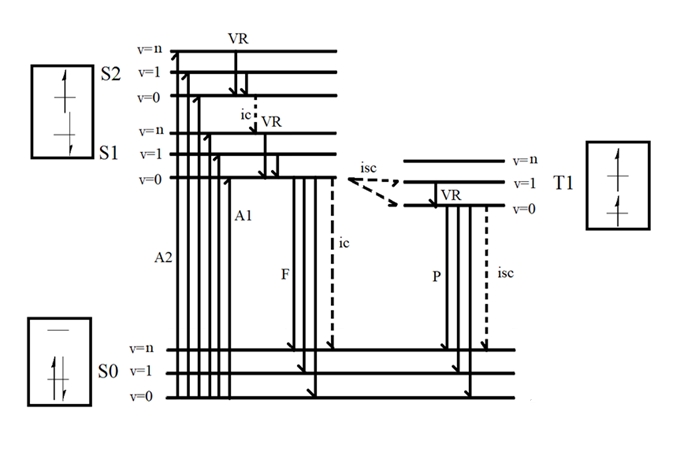
分子荧光光度法在药物分析中具有很高的应用价值。它能够实现对微量物质的检测和定量分析,具有很高的选择性和灵敏度,在药物分析中应用广泛。一、分子荧光产生的机理 1.
查看详情
真实世界研究(real-world study,RWS)起源于药物上市后评价的实用性临床研究,开始时是指药物在实际临床实践中应用的进一步评价。此时,可能将药物应用于各类不同情况或状态
查看详情
本指导原则旨在指导注册申请人对弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒抗体及G型免疫球蛋白(Immunoglobulin G, IgG)抗体亲合力检测试剂注册申报资料的准备及撰写
查看详情
本指导原则旨在指导注册申请人对单纯疱疹病毒核酸检测及分型试剂注册申报资料的准备及撰写,同时也为技术审评部门提供参考。 本指导原则是对单纯疱疹病毒核酸检测及分
查看详情
编者按:医疗器械注册审查指导原则(以下简称指导原则)作为医疗器械技术审评的新工具、新方法、新标准,在提高科学审评能力、促进产业高质量发展进程中发挥着重要作用。器审
查看详情
本指导原则旨在指导注册申请人对乙型肝炎病毒(hepatitis B virus,HBV)脱氧核糖核酸(deoxyribonucleic acid, DNA)检测试剂注册申报资料的准备及撰写,同时也为技术审评部门
查看详情
本指导原则旨在指导注册申请人对病原体特异性M型免疫球蛋白(Immunoglobulin M,IgM)定性检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评
查看详情
本指导原则旨在指导注册申请人对流行性感冒病毒(以下简称流感病毒)抗原检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
查看详情