24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
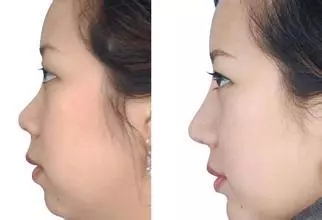
整形用面部植入假体注册技术审查指导原则(2020年第36号)本指导原则旨在为药品监管部门对注册申报资料的技术审评提供技术指导,同时也为注册申请人进行整形用面部植入假体的产品注册申报提供参考。本指导原则系对整形用面部植入假体的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
查看详情
肌腱韧带固定系统注册技术审查指导原则(2020年第36号)本指导原则旨在为注册申请人进行肌腱韧带固定系统产品注册申报提供参考,同时也为审评机构对注册申报资料的技术审评提供技术指导。本指导原则系对肌腱韧带固定系统产品的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
查看详情
全膝关节假体系统产品注册技术审查指导原则(2020年第36号)本指导原则旨在为注册申请人进行全膝关节假体系统产品的注册申报提供技术指导,同时也为医疗器械监督管理部门对注册申报资料的审评提供技术参考。本指导原则系对全膝关节假体系统产品注册申报资料的一般要求,注册申请人应依据具体产品的特性确定其中的具体内容是否适用,并对注册申报资料的内容进行充实和细化。
查看详情
3D打印髋臼杯产品注册技术审查指导原则(2020年第36号)本指导原则旨在帮助和指导注册申请人对3D打印(下称:增材制造)髋臼杯产品注册申报资料进行准备,以满足技术审评的基本要求。同时有助于审评机构对该类产品进行科学规范的审评,提高审评工作的质量和效率。本指导原则是对增材制造髋臼杯产品注册申报资料的一般性的原则要求,注册申请人/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
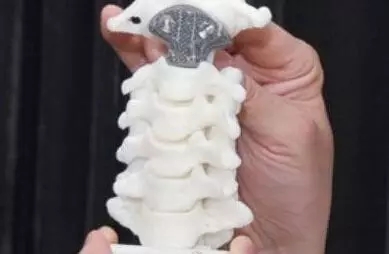
3D打印人工椎体注册技术审查指导原则(2020年第36号)本指导原则旨在帮助和指导注册申请人对3D打印人工椎体产品注册申报资料进行准备,以满足技术审评的基本要求。同时有助于审评机构对该类产品进行科学规范的审评,提高审评工作的质量和效率。本指导原则系对3D打印人工椎体注册申报资料的一般要求,注册申请人/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
查看详情
冠状动脉药物洗脱支架临床试验指导原则(2018年第21号)为了进一步规范冠状动脉药物洗脱支架产品上市前的临床试验,并指导该类产品申请人在申请产品注册时临床试验资料的准备,制订本指导原则。本指导原则系对冠状动脉药物洗脱支架产品临床试验的一般要求,申请人可依据具体产品的特性对临床试验方案的内容进行充实和细化。本指导原则虽然为该类产品的临床试验及申请人在申请产品注册时临床试验资料的准备提供了初步指导和建议,但不会限制医疗器械相关管理部门及该类产品的技术审评、行政审批,以及申请人对该类产品临床试验资料的准备工作。
查看详情
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)精神,国家药监局组织起草了《医疗器械拓展性临床试验管理规定(征求意见稿)》,面向公众征求意见。
查看详情
2020年6月8日,国家药监局发布关于药物临床试验必备文件保存指导原则的通告(2020年第37号),文件自自2020年7月1日起施行。
查看详情