24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

体外诊断试剂注册与备案管理基本数据集
1 范围 本文件规定了体外诊断试剂注册与备案管理所涉及的基本数据集、数据子集等相关内容,覆盖体外诊断试剂监管基础信息以及

1 范围 本文件规定了医疗器械注册与备案管理所涉及的基本数据集、数据子集等相关内容,覆盖医疗器械监管基础信息以及医疗器械注册与备案的申请、受理、审评、临床试验、
查看详情
1、哪些产品可以申请优先检验? 下列产品在标准不降低、程序不减少的前提下,可优先安排检验:(1)经国家药品监督管理局确认或符合江苏省药品监督管理局要求的创新医疗器械产
查看详情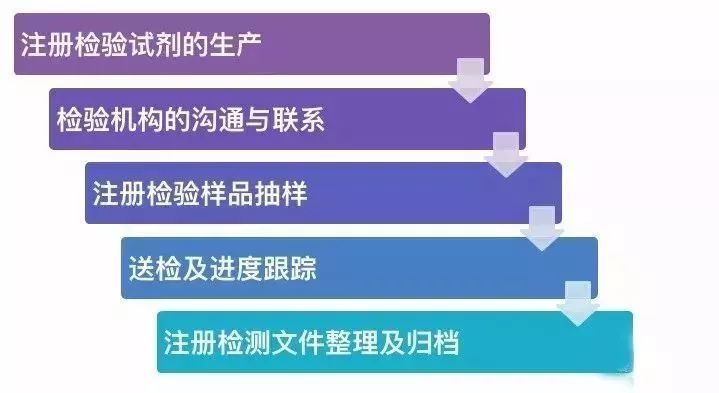
体外诊断试剂注册是食品药品监督管理部门根据注册申请人的申请,依照法定程序,对其拟上市体外诊断试剂的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。
查看详情
与抗肿瘤药物同步研发的原研伴随诊断 试剂临床试验注册审查指导原则一、前言 随着肿瘤生物学研究的进展,一些新的作用机制、作用靶点的抗肿瘤药物不断涌现,同时,临床
查看详情
PD-L1检测试剂临床试验—结果重现性研究注册审查指导原则
一、前言 近年来,以程序性细胞死亡蛋白1 (Programmed cell death protein 1, PD-1)/程序性死亡配体1 (

美国食品药品监督管理局(FDA)于2022年4月公布了《医疗器械网络:质量体系考量与上市前申报指南》草案再次公开征求意见,拟取代2014年10月发布的《医疗器械网络安全上市前申
查看详情
弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒抗体及 G型免疫球蛋白抗体亲合力检测试剂 技术审查指导原则
本指导原则旨在指导注册申请人对弓形虫、风疹病毒、