24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

当项目团队组员,或是有关工作人员犯错误时,PM要有细心协助其改正错误,要想团队组员能团结一致在项目经理的周边,接纳项目经理的领导干部,培养好的生长习性,项目经理就务必学好宽容项目团队组员,并寻找适当的方式与方法。
查看详情
医疗器械注册电子申报信息化系统(eRPS系统)于2019年6月24日正式启用以来,运行稳定,申报资料的质量和提交效率明显提高。但在运行过程中发现少数未完结事项存在短时间内多次重复提交的现象,此类情形将严重影响受理审核的办理进度。
查看详情
近年来,中国医药研发行业态势大好,对CRA的要求不断发展。前几日,1个工作1年多的小A跑来和小编发牢骚。一开始,和我许多小A相同,满腔喜悦和期待的进入了这家CRO企业,工作第一日就拿到企业千多字的《CRA具体工作岗位职责》,主要包括七个大类,30多个小类。接下去,经常的加班加点、公出,各种各样紧急事件五花八门。
查看详情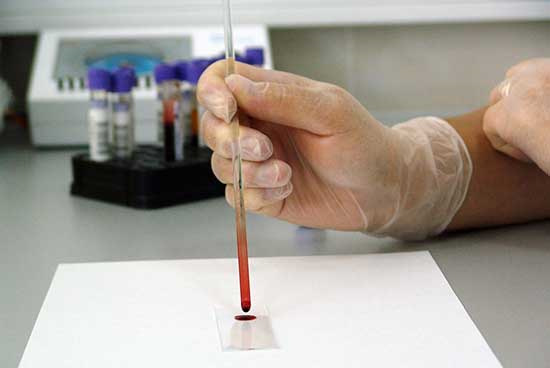
依据2004年《医疗器械临床试验规定》(局令5号)第三条规定:医疗器械临床试验是指:获得医疗器械临床试验资格的医疗机构(以下称医疗机构)对申请注册的医疗器械在正常使用条件下的安全性和有效性按照规定进行试用或验证的过程。医疗器械临床试验的目的是评价受试产品是否具有预期的安全性和有效性。以下是CRA和CRC在日常工作当中常常会遇到的一些医械临床术语,已知者温习,未知者科普。临床术语相对基础,如有不全,请告知我们给予补充。
查看详情
9月18日,国家药品监督管理局发布通告,出台了《晚期非小细胞肺癌临床试验终点技术指导原则》,旨在规范和指导我国治疗晚期非小细胞肺癌药物的临床试验设计和终点选择,提供可参考的技术规范。《原则》所涉及的观点代表了当前NMPA对晚期NSCLC临床试验设计和终点选择的审评认识,适用于支持晚期NSCLC适应症注册的临床试验设计及终点选择,NMPA鼓励研发从业人员探索科学创新的终点和试验设计,并及时与NMPA的审评部门沟通和交流。
查看详情
临床研究行业的特点也决定了CRO行业未来发展的方向。而新技术的不断应用,又是推动行业发展的主要动力。CRO行业未来究竟如何?本文从临床研究特点切入进行了分析。
查看详情
致各部门同事:在中秋佳节来临之际,飞速度提前祝大家节日快乐,祝您和家人阖家欢乐,幸福美满!
查看详情
面对更为严苛的飞检环境,医疗器械生产企业该如何应对GMP飞行检查?CRO临床合作组织为医疗器械生产企业(IVD企业)总结了几点关于GMP飞行检查对医疗器械企业的建议......
查看详情