24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
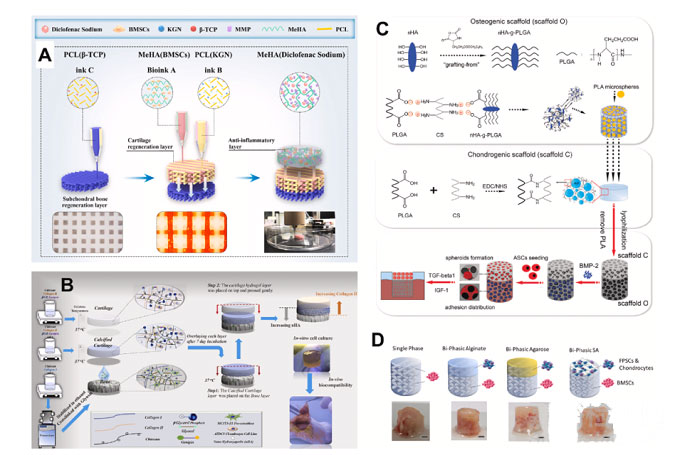
近期,澳大利亚悉尼科技大学高级讲师Jiao Jiao Li在科爱创办的期刊Bioactive Materials上发表综述文章:用于修复骨软骨缺损的多相支架-临床前研究进展。文章详细总结了自20
查看详情
法规依据: 根据《医疗器械生产质量管理规范》第四十九条要求: 企业应当对生产的特殊过程进行确认,并保存记录,包括确认方案、确认方法、操作人员、结果评价、再确认等内
查看详情
各有关单位及个人:按照国家药品监督管理局要求,国家药品监督管理局医疗器械标准管理中心牵头,组织成立起草工作组,研究编制《医用敷料类产品分类界定指导原则》(以下简称《指导原
查看详情
中医舌诊设备在我国属于第二类医疗器械注册产品,本文为大家介绍中医舌诊设备注册流程、费用和要求。
查看详情
对于有源医疗器械注册产品来说,如何确定有源医疗器械的使用期限?应该考虑哪些因素?一起看正文。
查看详情
对于有源医疗器械注册产品来说,有源医疗器械注册检验相对专业和复杂,且有关医疗器械注册检验报告发补项是常见事项,因此,本文为大家介绍有源医疗器械注册检验报告常见问题。
查看详情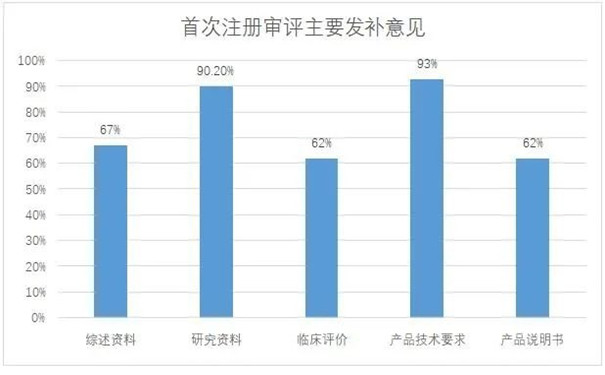
2023年4月28日,上海市药品监督管理局发布2022年度第二类有源医疗器械首次注册技术审评常见问题分析,2022年上海市医疗器械化妆品审评核查中心共计受理第二类有源医疗器械首次注册92件,其中91件进行了发补,最常见的问题为:产品技术要求、研究资料、综述资料。一起来了解上海市第二类有源医疗器械注册审评常见问题有哪些。
查看详情
近日,国家药监局发布了截至2023年7月底的医疗器械注册与生产许可备案数量统计,揭示了我国各省在医疗器械领域的积极发展态势。这一数据呈现了医疗器械行业的整体状况,展现了各
查看详情