24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

7月12日,国家药监局召开集中带量采购中选医疗器械质量监管工作汇报会。2家冠脉支架、4家人工关节集采中选企业汇报了集采中选产品、企业质量管理体系运行情况以及保障产
查看详情
近日,重庆市药监局和四川省药监局联合印发《川渝地区医疗器械生产跨省市监管办法(试行)》(以下简称《办法》),对川渝两地跨省市委托生产的医疗器械注册人、受托生产企业开
查看详情
脊柱国采,1号文件下发7月11日晚间,国家组织高值医用耗材联合采购办公室发布《国家组织骨科脊柱类耗材集中带量采购公告(第1号)》(以下简称“《公告》”)。 《公
查看详情
随着IT技术在医疗行业的广泛应用,医疗器械软件注册产品或是含软件医疗器械产品,必将越来越多出现在临床应用中。对于医疗器械软件注册产品这么个特殊形态的产品来说,检测报告中对照片的要求。
查看详情
2022年湖北省省级临床输血重点专科评审工作方案
为充分发挥临床输血重点专科的引领和示范作用,不断提高我省临床输血技术和管理水平,促进临床输血科能力与规范化建设,

—、专科基本条件 (一)所在医院为三级医院; (二)该专科整体实力强,医疗技术水平高; (三)专科医疗质量好,工作绩效高; (四)专科人才形成梯队,年龄结构、知识
查看详情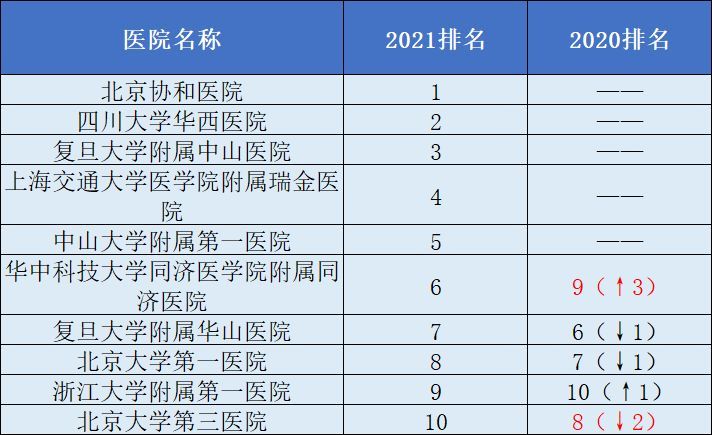
同时,公布了最新的中国顶级医院100强、地级城市医院500强、县级医院500强、中医医院500强等多个排行榜。在“2021年顶级医院100强”榜单中,北京协和医院、四川大学
查看详情
2022年5月13日,山东省药品监督管理局山东省科学技术厅山东省工业和信息化厅山东省卫生健康委员会山东省医疗保障局关于印发《关于促进医疗器械产业高质量发展的十六条措施》,包括加速医疗器械注册审评审批及促创新多项政策,此外还包括:医疗器械注册人因合并、重组、分立、股份转让等原因改变企业名称,但产品生产地址、标准、生产工艺、工序等没有发生改变的,参照注册人名称发生变化情形申请登记事项变更。
查看详情