24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

所谓医疗器械注册,是指食品药品监督管理部门根据医疗器械注册申请人的申请,按照法定程序,拟上市医疗器械的安全性、有效性研究和结果进行系统评估,以决定是否同意其申请过程。因
查看详情
昨天收到一位用户的留言:“想考一个GCP的证书,却在国家食品药品监督管理总局的网站上找不到报名的入口,求告诉哪里报名GCP考试!!能拿国家级GCP证书的,找工作用的。谢谢!!!!”
查看详情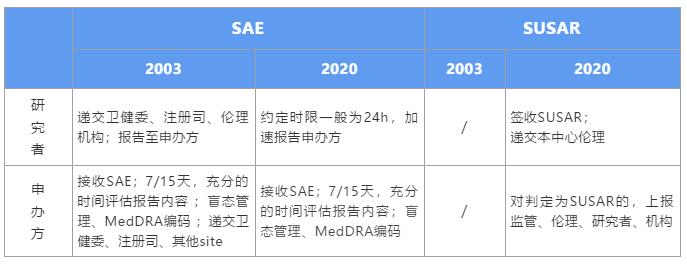
新版GCP对于申办方的影响是全方位的,就SAE个例报告处理方面,强化了申办方的主体责任,细化了申办方对SAE的管理流程。在此,我们详细解读,在新规之下,该如何高效、合规的处理SAE。
查看详情
医疗器械分为三类,一类不需要医疗器械运营企业许可证,二类、三类需要办理。要求《医疗器械经营企业许可证》必须具备以下条件: (一)有与经营规模和经营范围相适应的质
查看详情
分享一份来自德阳市人民医院的GCP培训ppt课件(文末可下载)。
查看详情
gcp证书有什么用?这个问题应该刚接触临床行业的小伙伴问的比较多,比如CRO公司的临床项目协助人员(CRA/CRC/项目经理等)、医院的临床项目团队(主要研究者/团队成员)和一些生产企业的内部人员(临床项目负责人等)都有这个证,这样看来这个证还挺重要的。下面你关心的重点来了!!!!
查看详情
感谢作者的辛勤付出,文章全篇关于GCP的点点滴滴,文章字数有点多,需要您耐心观看,看完受益匪浅。
查看详情
器械的临床试验和药品一样,需要遵循ICH-GCP以及各种临床试验相关的法规;但由于器械的产品特殊性,导致它和药品的试验有明显的区别。
查看详情