24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

2021年北京市GCP证书线上培训班来啦!具备GCP证书发放资质,效力等同高研院,支持备案。GCP证书是进入临床行业的敲门砖,在CRO公司、医疗机构及各大生产企业应用广泛。目前飞速度已为超过400名有需求的小伙伴,成功发放GCP证书。
查看详情
深圳申请第二类医疗器械注册证的条件《医疗器械注册管理办法》(国家食品药品监督管理总局令第四号)在中华人民共和国境内销售、使用的医疗器械,应当按照本办法的规定申请注册
查看详情
常有人问?第二类医疗器械经营申请如何备案?飞速度许可证办理网为申请人整理如下:上海第二类医疗器械如何备案?1、《医疗器械监督管理条例》(中华人民共和国国务院令第680号,2017
查看详情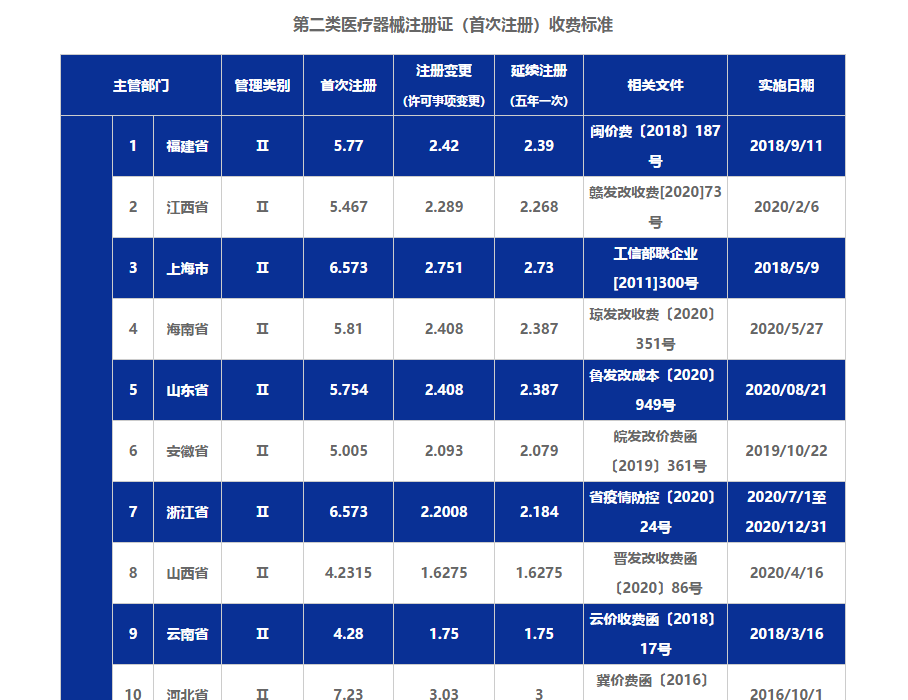
二类医疗器械注册不是一个比较简单的事情,从文件、场地、人员等元素的费用考量外,还需要知道代办费用和首次注册收费费用。那么这两种收费情况都是怎么样的,一起随飞速度来看看
查看详情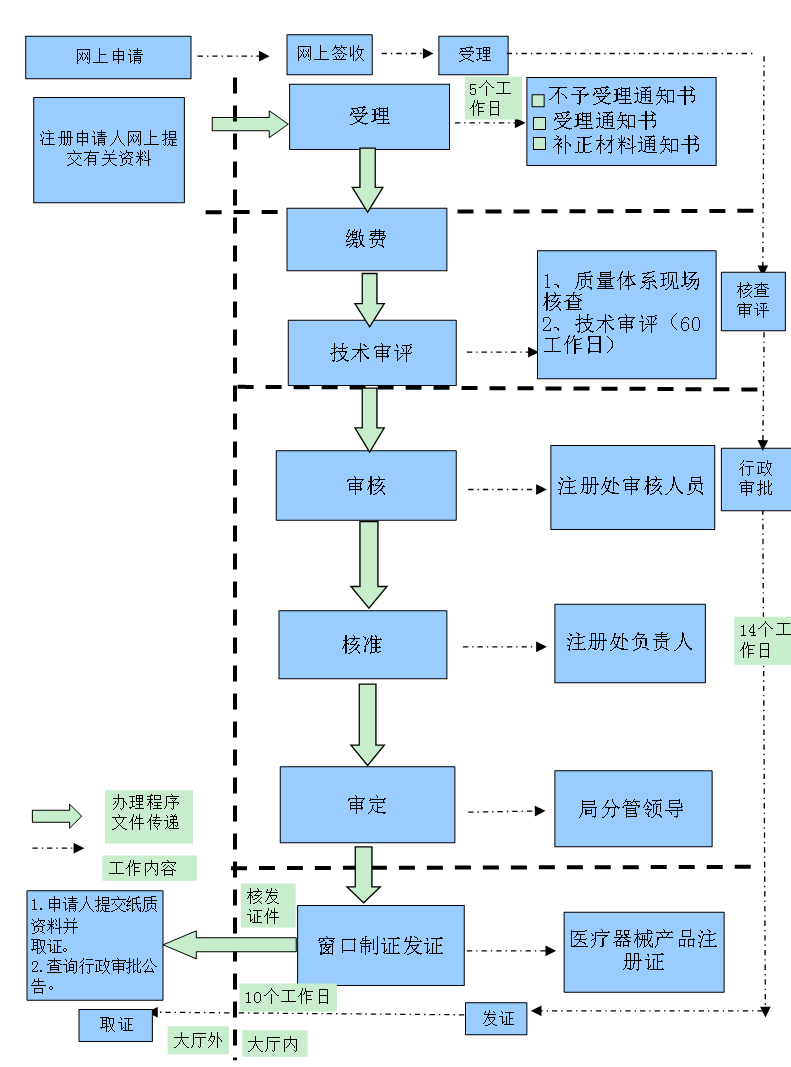
第二类医疗器械产品注册证的办理条件: 1.申请注册的产品已列入《总局关于发布医疗器械分类目录的公告》(2017年第104号)附件《医疗器械分类目录》,管理类别为第二类。(
查看详情
第二类医疗器械注册证首次申请注册是需要收费的,和第三类医疗器械注册不同的是,第二类医疗器械注册证注册费每个省份都是不一样的,申请第二类医疗器械注册证可以根据地域等多种
查看详情
医疗器械注册是食品药品监督管理部门根据医疗器械注册申请人的申请,依照法定程序,对其拟上市医疗器械的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过
查看详情
由于新冠疫情影响,医疗器械产品进行CE认证的新法规MDR推迟1年即2021年5月26日实施,那现在欧盟委员会的筹备进展如何呢?2021年4月1日欧盟委员会的官网上发布了医疗器械专家组的相关信息,确定了先建立依据欧盟委员会第2019/1396号决议而指定的12个领域的专家组,并公布了现有的专家组的名单以及后续招募的要求;同时确认专家实验室和欧盟参比实验室(EURL)将在稍后阶段建立。
查看详情