24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
随着科技的不断进步和社会需求的变化,中医器械与设备受到了越来越多的关注。近年来,我国政府出台了一系列政策措施,鼓励利用现代科学技术研发具有中医特色的医疗器械与设备
查看详情
根据《临床儿科学》中的定义,儿科的范围主要分为新生儿期(出生后至刚满28天)、婴儿期(出生至满1周岁)、幼儿期(1岁至满3周岁)和小儿(3岁直至18岁及以下)。对于儿科应用范
查看详情
本指导原则旨在指导注册申请人进行富血小板血浆制备器注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供参考。 本指导原则是对富血小板血浆制
查看详情
为进一步贯彻落实《中共中央 国务院关于促进中医药传承创新发展的意见》中“支持珍稀濒危中药材替代品的研究和开发利用”的有关部署,加强珍稀濒危野生药用动
查看详情
吉林省药品监督管理局关于批准注册医疗器械产品公告 (2024年第9期) 2024年9月,吉林省药品监督管理局共批准注册第二类医疗器械产品57个。(具体产品见附件) 附件:202
查看详情
2024年9月,辽宁省药品监督管理局共批准注册境内第二类医疗器械产品4个(详见附件)。 特此公告。 附件:2024年9月批准注册第二类医疗器械产品目录 辽宁省药品监督
查看详情
根据《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》等相关规定,现将2024年9月贵州省药品监督管理局批准境内第二类医疗器械及体外诊断试剂有关情况
查看详情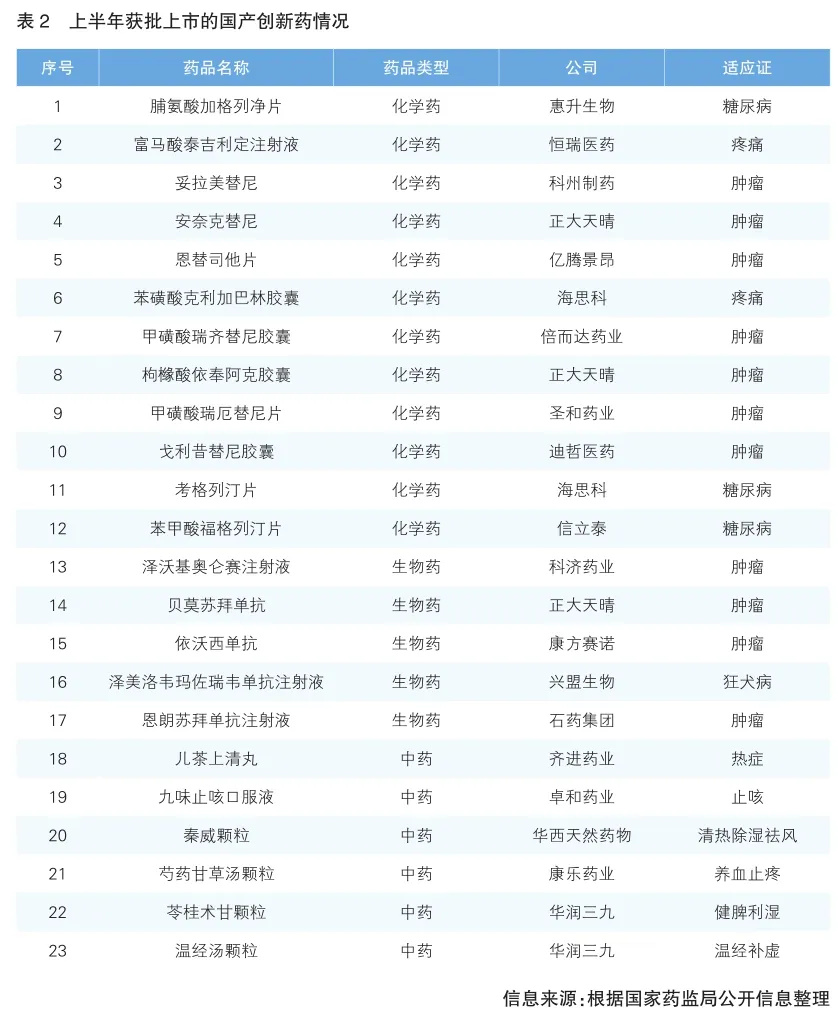
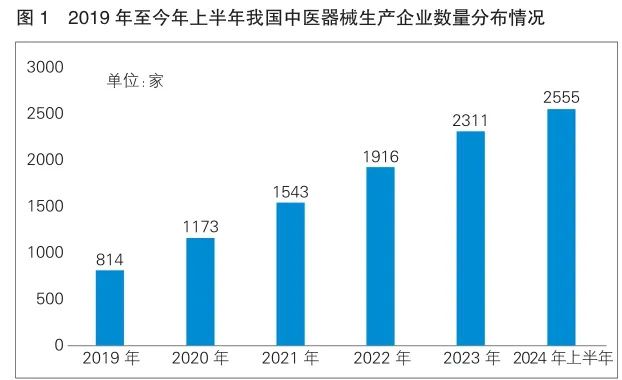
2024年是实现“十四五”规划目标任务的关键一年,上半年我国宏观经济运行总体平稳,新动能加快成长。医药工业消除了新冠疫情影响,经济运行呈现积极迹象,高质量发展
查看详情