24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

根据《医疗器械注册与备案管理办法》和《体外诊断试剂注册与备案管理办法》的要求,现将广西壮族自治区2024年9月第二类医疗器械产品注册相关信息予以公告。 2024年9
查看详情
按照《国家药监局综合司关于加强第一类医疗器械备案管理的通知》(药监综械注〔2023〕89号)要求,为进一步加大公开力度,现将2024年第三季度天津市药品监督管理局备案的91个
查看详情
按照《国家药监局综合司关于加强医疗器械注册备案信息发布工作的通知》(药监综械注函〔2024〕52号)要求,为进一步加大医疗器械产品注册信息公开力度,主动接受社会监督,现将
查看详情
2024年9月,安徽省药品监督管理局共批准首次注册第二类医疗器械产品27个,产品相关信息见附件。 特此公告。 附件:安徽省第二类医疗器械首次注册产品目录(2024年9月)
查看详情
一、一图读懂《黑龙江省第二类医疗器械研发和样品生产地址变更指南(试行)》二、黑龙江省第二类医疗器械研发和样品生产地址变更指南(试行)第一章 总  则 第一
查看详情
为进一步发挥药品、医疗器械产业链内部监督作用,及时发现和控制药品、医疗器械安全风险,国家药监局组织起草了《关于对药品、医疗器械质量安全内部举报人举报实施奖励的公
查看详情
随着医疗科技的进步和社会需求的增长,医疗器械行业在全球范围内都迎来了快速发展。作为保障公众健康的重要手段之一,医疗器械的质量和安全性直接关系到使用者的生命安全。
查看详情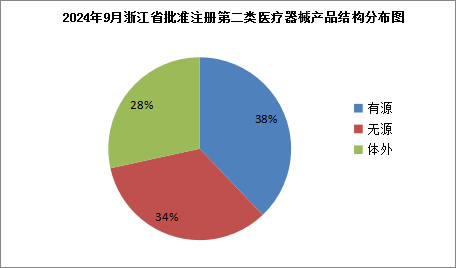
2024年9月,浙江省药品监督管理局共批准注册第二类医疗器械产品95个,其中有源类36个,无源类32个,体外诊断试剂27个(具体产品见附件)。 按照注册申请人所在辖区分析,批准注
查看详情