24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

前言 本文件按照GB/T 1.1—2020《标准化工作导则 第1部分:标准化文件的结构和起草规则》的规定起草。请注意本文件的某些内容可能涉及专利。 本文件的发布机
查看详情
前言 本文件按照GB/T 1.1—2020《标准化工作导则 第1部分:标准化文件的结构和起草规则》的规定起草。 请注意本文件的某些内容可能涉及专利。 本文件的发布机
查看详情
职业化专业化医疗器械检查员依法对医疗器械研制、生产等场所、活动进行合规确认和风险研判,是加强监管、保障医疗器械安全有效的重要支撑力量。医疗器械检查专业性、技术
查看详情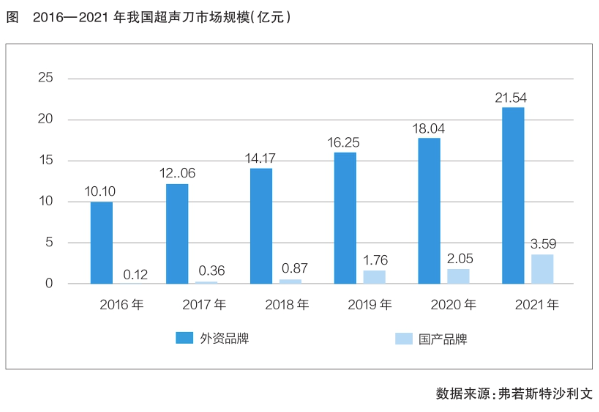
超声刀是一种高能聚焦超声仪器,其利用电致伸缩效应(电介质在电场中发生弹性形变的现象)或磁致伸缩效应(磁性物质在磁化过程中因外磁场条件的改变而发生几何尺寸可逆变化)
查看详情
日前,西门子医疗中国正式发布全新“国智创新”本土化战略,宣布将通过“推动实现全产品线国产化”“基于中国市场需求进一步深入创新研发”
查看详情
2022 年 4 月 11 日,美国FDA发布《外科缝线 – 基于安全和性能的途径的性能标准》指南文件。旨在提供支持《基于安全和性能的途径》的外科缝线性能标准。计划使用该
查看详情
1、体外诊断试剂临床试验数据库的递交应注意哪些问题 按照申报资料要求,自2022年1月1日起,所有通过临床试验路径进行临床评价的体外诊断试剂均应提交临床试验数据库。申请
查看详情
要求一:内控标准不得低于国内外各国药典标准Q1. 请参考现行版BP在原料药内控标准中增加pH的控制。原申报资料中原料内控标准无pH控制,应根据多批数据,增加pH的控制。Q2. 参考
查看详情