24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

医疗器械注册自检有什么要求?企业在采用医疗器械注册自检方式时,有哪些需要注意的事项?可参考本文:医疗器械注册自检质量管理体系现场检查要点.
查看详情
随着生物技术的发展,及科研人员、产业对生物标志体系的探索、研究,体外诊断试剂变得越来越灵敏、准确、便宜、易用。由此,变更注册在体外诊断试剂行业也是常规事项。本位为讲解第二类体外诊断试剂变更注册时变更阳性判断值或参考区间应提交什么材料?
查看详情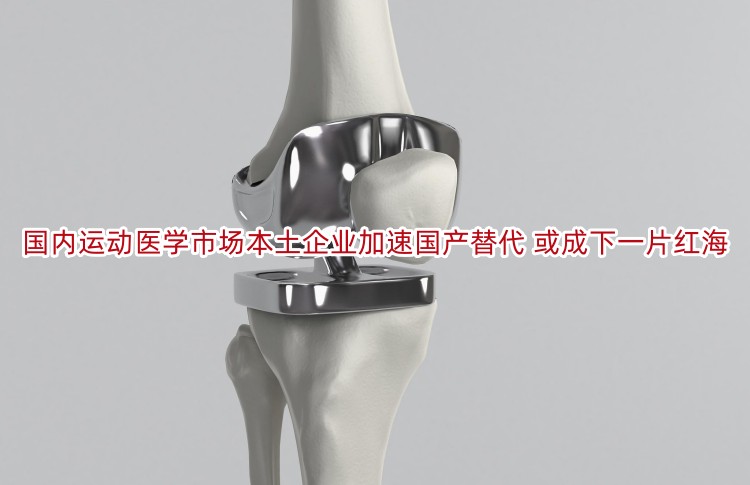
前言随着人们对于运动与健康领域的重视程度逐步加大,运动医学潜在市场需求端不断增加;而在骨科器械被纳入集采的大背景下,骨科厂家原始利润下降,纷纷寻找转型机会,运动医学目前
查看详情
近日,国家药品监督管理局经审查,批准了北京朗视仪器股份有限公司生产的“耳鼻喉双源锥形束计算机体层摄影设备”创新产品注册申请。 该产品由大视野成像系统
查看详情
动物试验研究 医疗器械安全性和有效性评价研究应采用科学、合理的评价方法,其中动物试验是重要手段之一,其属于产品设计开发中的重要研究,可为产品设计定型提供相应的证据支
查看详情
1.机构和人员 1.1.1 应当建立与医疗器械生产相适应的管理机构,具备组织机构图。 查看提供的质量手册,是否包括企业的组织机构图,是否明确各部门的相互关系。 *1.1.2
查看详情
腹腔内窥镜手术系统技术审查指导原则 第1部分:手术器械(征求意见稿) 本指导原则旨在指导注册申请人对腹腔内窥镜手术系统用不向患者提供能量的手术器械和高频手术器械
查看详情
手术机器人是一种先进的医疗设备,借助微创伤手术及相关底层技术的发展而发明。手术机器人是医疗机器人的一种细分领域。手术机器人,即外科医生能够通过远程控制,并通过微小
查看详情