24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
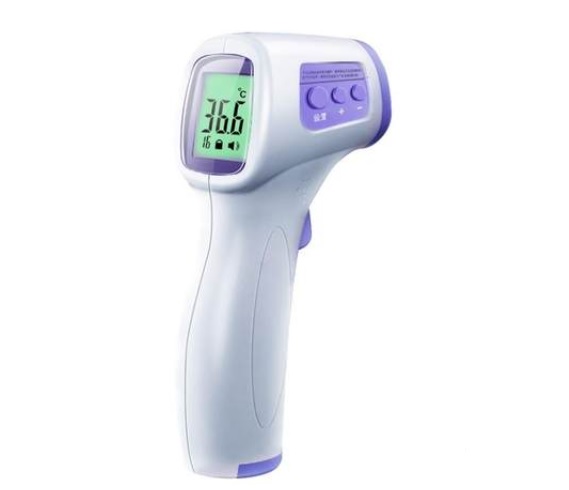
医疗器械注册(额温计)申报资料上需要特别注意什么?
查看详情
史上最大试剂“买家团”,来了! 今年初,国家医保局开会就确定了2022年重点推进的联盟集采,其中就包括,由江西牵头开展的肝功生化试剂采购联盟,彼时就预计会有相当数
查看详情
7月19日,作为2022年“全国医疗器械安全宣传周”重要活动之一的“新法规下的医疗器械质量管理体系经验交流会”在京召开。会上,6家企业代表分别围绕质
查看详情
为推进医疗器械唯一标识(UDI)制度实施,指导省内医疗器械注册人备案人、经营企业和医疗机构积极实施应用UDI,山东省局印发《山东省医疗器械唯一标识(UDI)实施应用指南》,主要包括适用范围、基本知识和实施流程三个部分。其中,实施流程部分分为注册人备案人、经营企业、医疗机构三类主体。同时,根据生产环节特殊要求,实施个性化流程。特别是
查看详情
一、适用范围及声明 医疗器械注册人、备案人委托具备相应条件的企业生产医疗器械,应当与受托生产企业签订《医疗器械委托生产质量协议》(以下简称《质量协议》),明确双方在
查看详情
前言:以习近平新时代中国特色社会主义思想为指导,深入贯彻落实习近平总书记关于粤港澳大湾区建设的重要指示精神和要求,按照党中央、国务院决策部署和市场监管总局等8部门
查看详情
前言:我国医疗服务模式正从院中诊疗转向院前-院中-院后的连续性服务方向转变,强烈的院后的康复需求正刺激大量医疗机构升级换代,康复医疗器械潜在市场空间巨大。全国这些医
查看详情
技术的进步,需求的提升、变化,医疗器械更新、迭代是普遍情况。但是,医疗器械注册证仅针对已注册产品,在此基础上,如果企业需要增加新的规格型号,如何处理呢?
查看详情