24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

呼吸机同品种临床评价注册审查指导原则 (征求意见稿)
本指导原则旨在指导注册申请人开展呼吸机同品种临床评价,同时为技术审评部门审评呼吸机同品种对比临床评价
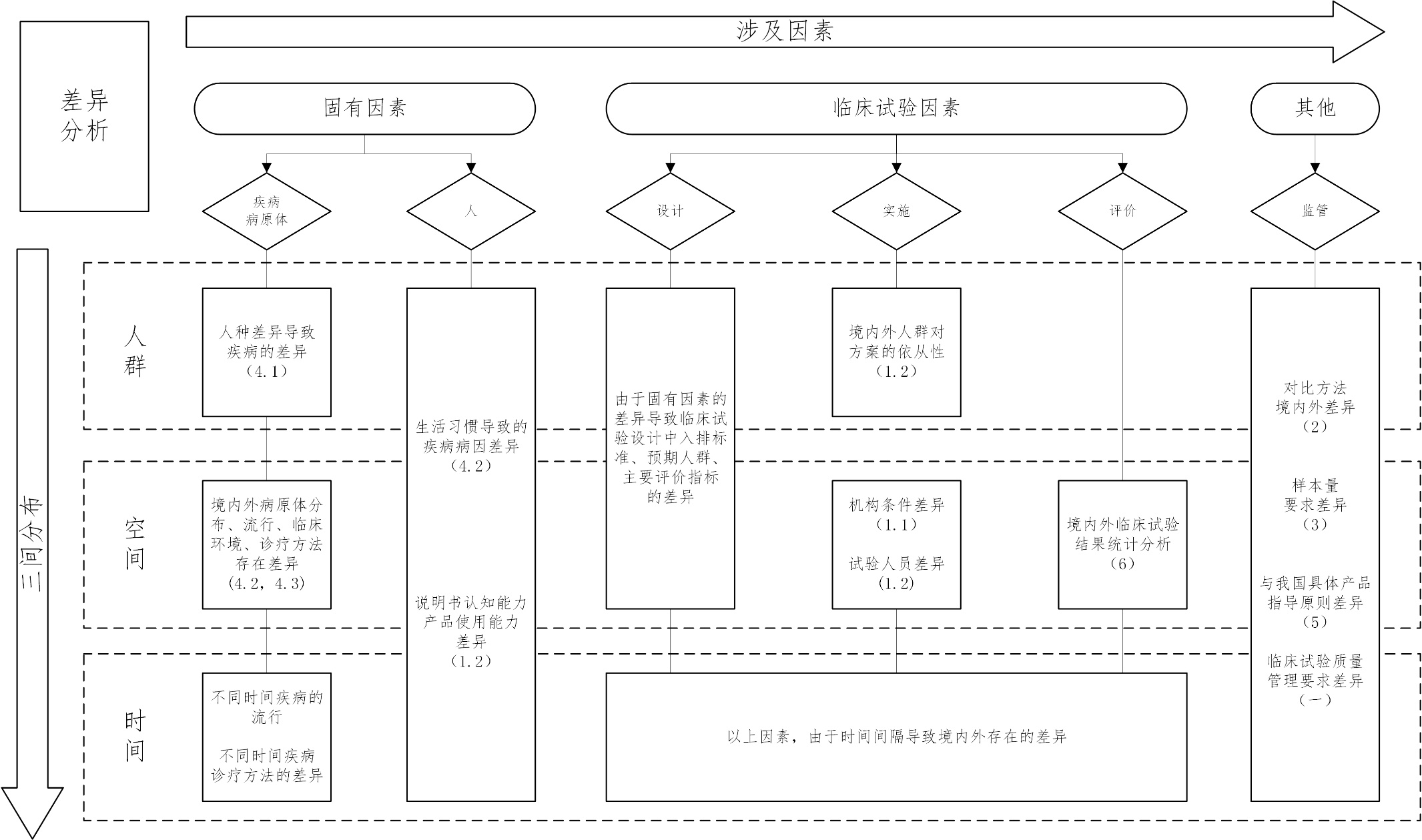
使用体外诊断试剂境外临床试验数据的注册 审查指导原则 为避免或减少重复性临床试验,促进医疗器械技术创新,加快医疗器械在我国的上市进程,更好地满足公众对医疗器械
查看详情
2021年12月31日消息,NMPA对外发布《第一类医疗器械产品目录》。据悉,《第一类医疗器械产品目录》自2022年1月1日起正式施行。液体膏状敷料将不能按照一类医疗器械备案申报。
查看详情
?为贯彻落实国家药监局于2021年9月印发的《关于做好第二批实施医疗器械唯一标识工作的公告》,浙江省药品监督管理局、浙江省卫生健康委员会、浙江省医疗保障局三部门联合印发《浙江省推进实施医疗器械唯一标识 (UDI)工作方案》。
查看详情
什么情形下可提交医疗器械说明书更改告知审查申请?
答:依据《医疗器械说明书和标签管理规定》第十六条,不属于变更注册范围内的说明书其他内容发生变化的,应当向医疗器械注册的审批部门书面告知,并提交说明书更改情况对比说明等相关文件。
我中心收到说明书更改告知审查申请后将参考立卷审查要求对说明书更改告知申请的技术内容进行审查。审查过程中发现申请内容涉及需要注册人提供相应支持性资料的,将发出受理补正通知,明确写明该申请存在的具体问题和需要注册人提交的资料。对于经审查认为不属于说明书更改告知范围的,将在受理补正通知中向注册人明确不符合的具体内容和理由,以及按照变更注册办理的途径。

Your browser is not supported 中药是中华民族的瑰宝。《“十四五”国家药品安全及促进高质量发展规划》明确提出,健全符合中药特点的审评审批体系,加强中药监
查看详情
国家市场监督管理总局令第47号
《医疗器械注册与备案管理办法》已经2021年7月22日市场监管总局第11次局务会议通过,现予公布,自2021年10月1日起施行。 局长 张工 20
沪药监械注〔2022〕67号
本市各医疗器械临床试验机构:为贯彻《医疗器械监督管理条例》(国务院739号令),实施《医疗器械注册与备案管理办法》(市场总局令47号)《体外诊断试剂注册与