24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us


药物、器械、生命支持营养是普遍认同的疾病预防、治疗的三大领域。相比营养,药械组合产品在研究和临床应用上更加普遍和成熟,预期未来应用会更多。本文为大家科普药械组合产品注册申报流程。
查看详情
2020年10月10日,审评中心发布有关医疗器械注册?相关答疑,为大家解答有关灌流器产品需要控制哪些可沥滤物问题。
查看详情
进口医疗器械注册与国产医疗器械注册既有区别又有相同点,关于进口医疗器械注册是否需要检验,检验的要求与国产医疗器械注册检验有无差异,在哪来检验,本文为您介绍。
查看详情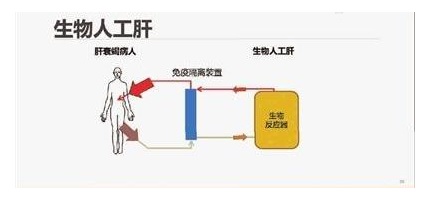
目前全球新型冠状病毒肺炎(COVID-19)疫情防治工作进入攻坚阶段,重型、危重型患者的有效救治是降低病死率的关键。人工肝血液净化系统可以清除炎症因子,减轻炎症反应对机体的损伤,对重型、危重型患者的救治具有重要临床意义。
查看详情
根据《医疗器械注册管理办法》,建立质量管理体系是产品注册的基本要求。而验证和确认又往往是体系核查的重中之重,特别是无菌医疗器械。
查看详情
医疗器械是执业药师药事管理与法规的重要内容,以下整理了一类、二类、三类医疗器械的区分理念,对于不熟悉一类、二类、三类相关知识的可以加强医疗器械类别区分观念。
查看详情
?临床试验是医疗器械注册上市前需要进行的一项重要评价环节,临床试验项目的质量控制和管理决定了临床试验能否顺利完成并得到科学有效的试验结果。
查看详情