24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

严谨意义来说,医疗器械的安全管控对象不只是患者,应该也必须保护好咱们的医务工作者们。本文带带大家一起了解有关接触类医疗器械注册?之医疗器械细胞毒实验标准与方法。
查看详情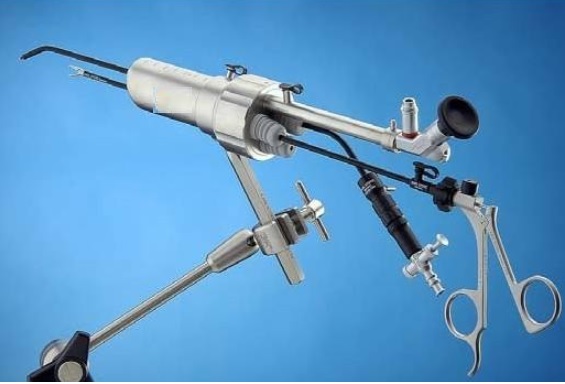
内窥镜是临床应用的大类器械之一,在腔内手术中广泛应用。本文为大家带来有关内窥镜手术系统中内窥镜及其附属设备注册相关事项官方解答。
查看详情
由于最近国内对于医疗器械行业做了一个大调整,医疗行业再次成为大众关注的焦点。医疗器械有注册和办理经营许可证两项业务,关于办理这些业务的专员,平日里有哪些工作要做,小编和大家具体讨论一下。
查看详情
在医疗器械临床试验?中,数据的获取是十分关键的一步。只有充足、正确、完整的数据才能得出最正确的结果,也是论证课题的重要依据。但是在医疗器械临床试验中,数据造假却是十分常见的事情,我们应该怎么处理呢?
查看详情
为加强医疗器械注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局于2018年1月5日发布了《动物源性医疗器械注册技术审查指导原则》(2017年修订版)。
查看详情
为贯彻实施中共中央办公厅 国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),加强医疗器械临床试验监督管理,进一步提高注册审查质量,根据《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第43号)要求,国家药品监督管理局于2018年6月4日发布了《无源植入性医疗器械临床试验审批申报资料编写指导原则》。
查看详情
作为的一名优秀的医疗器械注册工程师,需要熟悉医疗器械注册的相关法规、医疗器械分类、医疗器械的注册检测、生物学评价、产品标准、生产企业质量管理体系、以及注册申报的资料要求、审批流程等,另外还涉及欧洲、美国、日本的医疗器械监管体系。
查看详情
企业应积极主动,重视法律法规和标准学习,由专人负责政策法规、标准及相关审评指导原则的搜集、整理和应用指导,确保产品在设计开发过程中遵循法规要求;企业应努力提高自身技术水平,并在产品研发过程咨询临床、检验等各方专家意见,确保产品开发科学严谨,形成技术文件科学;从国家局层面统筹布局,就有源医疗器械目前存在的共性且难以解决的问题给出明确的政策通道。
查看详情