24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
体外诊断试剂安全和性能基本原则清单医疗器械应当实现申请人申报产品的预期性能,其设计和生产应当确保器械在预期使用条件下达到预期目的。这些器械应当是安全的并且能够实现其预期性能,与患者受益相比,其风险应当是可接受的,且不会损害医疗环境、患者安全、使用者及他人的安全和健康。
查看详情
2021年7月26日,药监总局发布关于公开征求《药械组合医疗器械注册审查指导原则(征求意见稿)》意见的通知,就药械组合医疗器械注册事项向公众公开征求意见。
查看详情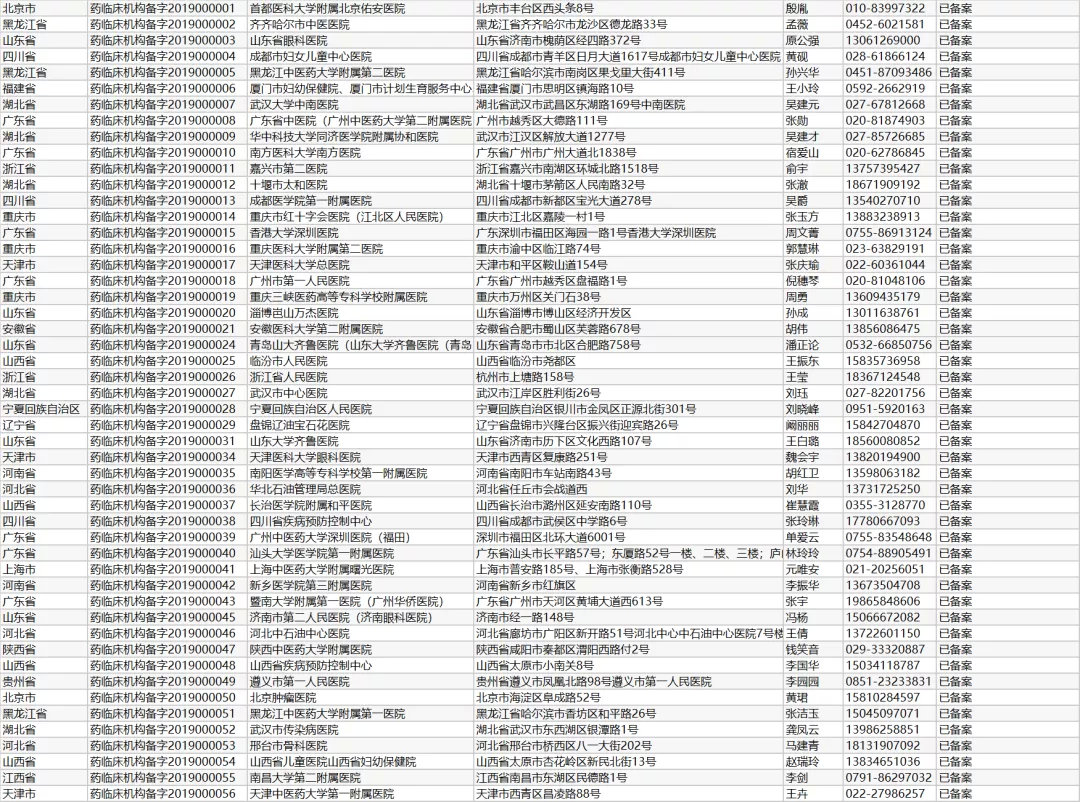
2019年11月29日,国家药监局 国家卫生健康委关于发布药物临床试验机构管理规定的公告(2019年第101号),《药物临床试验机构管理规定》。12月1日正式实施,以下是药物临床试验机构备案情况明细!
查看详情
为规范医疗器械的注册与备案管理,保证医疗器械的安全、有效。销售、使用的医疗器械,应当按照医疗器械注册管理办法的规定申请注册或者办理备案。专业的医疗器械注册法规解读对医疗器械企业、学员个人等多方收益!
查看详情
医疗器械延续注册申报资料要求及说明 1.境内注册人应当提交企业营业执照副本或事业单位法人证书复印件;境外注册人应当提交企业资格证明文件。
2.境外注册人应当提交在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件。
3.提交原医疗器械注册证及其附件的复印件、历次医疗器械变更注册(备案)文件及其附件的复印件。
4.如医疗器械注册证有效期内有新的医疗器械强制性标准发布实施,已注册产品为符合新的强制性标准所做的变化属于应当办理变更注册的,注册人应当提交申请延续注册前已获得原审批部门批准的变更注册(备案)文件及其附件的复印件。已注册产品为符合新的强制性标准所做的变化属于无需办理变更注册手续或者无需变化即可符合新的强制性标准的,注册人应当提供情况说明和相关证明资料。

第一类医疗器械备案的指导原则相对较少,部分省市按照国家药监相关法规制定要求。近日,天津市药监局发布公开文件,明确超声耦合剂产品办理第一类医疗器械备案要求。
查看详情
2021年9月22日,为进一步规范神经和心血管手术器械-刀、剪及针的注册申报和技术审评,我中心组织起草了《神经和心血管手术器械-刀、剪及针注册审查指导原则》(征求意见稿),现公开征求意见。
查看详情
临床试验机构选择
规定:两个或两个以上医疗器械临床试验机构中进行
多中心:按照同一方案,在三个及以上(含三个)临床试验