24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

医用防护服抗合成血液穿透性试验方法,范围:本试验使用合成血液确定在不同试验压强下,防护服对合成血液穿透的抵抗能力。方法:在持续施加的压强下以合成血液对防护服材料进行试验。目视检查材料上合成血液是否穿透。
查看详情
之前分别分享了医用外科口罩产品技术要求模板、医用防护口罩N95(灭菌)产品技术要求模板、一次性使用医用口罩产品技术要求模板,口罩产品已经分享完毕。防护服也是疫情期间耗量巨大,转厂制造防护服的企业也不在少数。本篇分享的是医用一次性防护服产品技术要求模板,供企业使用!(文末仍旧可免费下载,内含抗合成血液穿透性试验方法哦!)
查看详情
本篇分享的是医用外科口罩产品技术要求,去年,小编写了一篇医用外科口罩注册证办理流程,下证需要多久?的文章,让广大医用外科口罩生产企业对产品注册证办理流程周期有了一定了解,而产品技术要求是药监领导了解产品属性最直接的工具,由于口罩产品注册简单,产品技术要求含金量并不高,因此技术要求模板几乎是通用的,也不需要进行大改。
查看详情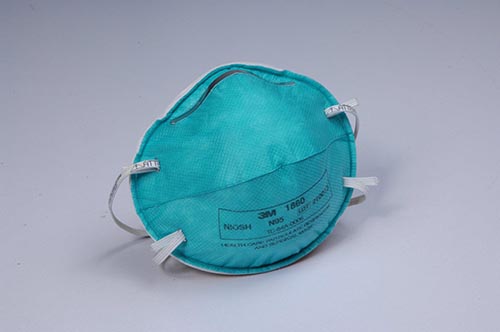
医用防护口罩与佩戴者面部具有良好的贴合性,可过滤空气中的微粒,阻隔飞沫、血液、体液、分泌物等的污染物,对非油性颗粒的过滤效率可达到95%以上,因此N95也属于医用防护口罩,是应对空气传播疾病常用的个人防护用品。上一篇我们分享了一次性使用医用口罩产品技术要求模板,本篇继续分享,老规矩文末有惊喜哦!
查看详情
一次性使用医用口罩由口罩面体和拉紧带组成,其中口罩面体分为内、中、外三层,内层为亲肤材质,中层为隔离过滤层(熔喷布就在这一层),外层为特殊材料抑菌层。这种高效医用口罩疏水透气性强,对微小带病毒气溶胶或有害微尘的过滤效果显著但不能有效过滤PM10和PM2.5,总体过滤效果良好,所用材料无毒无害佩带舒适。
查看详情
医疗器械是指单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的软件。目前医疗器械分为一类、二类、三类,其中一类医疗器械是指通过常规管理足以保证
查看详情
我们学习了什么是PD(方案偏离)和PV(方案违背),那么问题就来了:很多国内小公司和小药企,临床医学团队不是很完善(结构就是:医疗器械临床试验公司配备一个经理+几个CRA),很多问题需要CRA自己解决,问了项目经理等于没问(临床运营的经理也拿不准)。不像有些公司很规范,有主管技术的医学部,有自己医学顾问、医学经理、LM、项目经理、QA、LCRA、丰富经验的SCRA同事等人员,所以即使CRA发现了PD/PV,也是很痛苦,因为SOPs里面并没有说怎么处理,或怎么报,那我们应该怎么做呢,或其他同行是怎么做呢?
查看详情
熔喷布是医用外科口罩的重要组成部分,在当前大环境下对熔喷布的需求量仍旧稳定,熔喷布是判定口罩成为95%、99%过滤的标准,本文来源于河南医疗器械检测所,具体送检要求如下。
查看详情