24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

CRA如何有效监查ICF?CRA在医院做监查时,ICF是非常重要的监查内容。这里列出监查时常见注意事项谨供讨论:
查看详情
一个产品带有CE 标志(标记) 也就意味着其制造商宣告:该产品符合欧洲的健康、安全、与环境保护之相关法律中所规定 的基本要求。因而该产品是对:使用者(译者注:人)、宠物(译者注:家畜家禽)、财产(译者注:物业)、及环境(译者注:自然环境)都安全的产品。
查看详情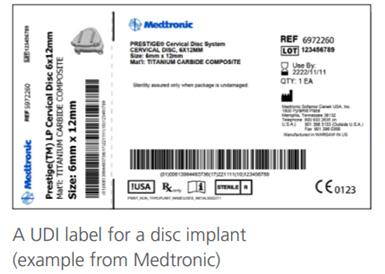
2020年8月,欧盟委员会发布了MDR和IVDR法规下对于UDI系统使用的常见问题解答,小编对其梳理和总结如下:
查看详情
以下对欧代、英代简单介绍,下期将针对欧洲注册、英国注册的要求推出详细的专题讲解,包括符合性声明、标签、文件等。
查看详情
UDI系统是在整个分销链和使用点对医疗器械追溯、监督管理识别医疗设备的一种手段。对医疗器械厂商来说并不是一件陌生的事情,2013年美国发布规定要求分阶段实施UDI系统,2017年欧盟发布的MDR/IVDR法规也导入了UDI系统,2019年中国开始对部分高风险的医疗器械开始UDI系统试点工作。那么如何确保各厂商正确合规的实施UDI系统。很多人可能认为UDI不就是在医疗器械本身、标签、包装上印刷上条码吗?其实不然,UDI系统不仅影响包装、标签的标注,而且几乎影响质量管理体系中的所有其他子系统。所以需要对整个质量体系进行调整,以确保UDI系统无缝结合。首先各医疗器械厂商应建立UDI系统的程序文件,详细规定UDI实施的流程。
查看详情
2020年12月21日,国务院常务会议审议通过了《医疗器械监督管理条例(修订草案)》(以下简称《修订草案》),意味着医疗器械行业母法第三次大修改即将接近尾声。这次修改是在医疗器械注册人制度试点的大背景下进行的,引起了行业产业的高度关注。
查看详情
近日,国际骨科临床转化期刊《Journal of Orthopaedic Translation》在线发表了由上海交大戴尅戎院士、郝永强教授团队和丁文江院士、袁广银教授团队合作发表的可降解镁合金骨钉1-2年的临床试验观察结果,所有患者术后内踝骨折愈合,功能恢复。研究证实了可降解镁合金螺钉治疗内踝骨折的临床疗效及其生物安全性,为全降解镁合金植入物等高端医疗器械进一步的临床推广应用奠定了坚实基础,相关成果以“Effectiveness and safety of biodegradable Mg-Nd-Zn-Zr alloy screws for the treatment of medial malleolar fractures”为题在线发表于Journal of Orthopaedic Translation,27 (2021) 96–100。这是国内首个可降解医用镁合金临床试验的公开报道,也是国际首款含有功能涂层的可降解镁合金骨钉的临床试验结果的公开报道,具有里程碑意义。
查看详情
新版GMP对文件和记录的要求,良好的文件系统是质量保证系统的基本部分,应当覆盖GMP的所有方面。其目标是制定所有物料的质量标准和规程以及生产和控制的方法,以保证生产相关的所有人员知道应做什么以及何时做;确保受权人了解产品所有信息以决定产品是否批准放行,保证书面记录的存在,可追溯性,保证提供相关记录和审计追踪以便调查。其确保验证、审查和统计分析所有数据的有效性。文件如何设计和使用取决于生产商。在某些情况下,下面描述的文件的一部分或全部可能在一起,但他们各自通常是相互独立的。
查看详情