24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

牙科纤维桩产品注册技术审查指导原则(2017年第44号)本指导原则旨在为申请人进行牙科纤维桩的注册申报提供技术指导,同时也为食品药品监督管理部门对注册申报资料的审评提供技术参考。本指导原则是对牙科纤维桩产品的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容进行充分说明和细化。申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需详细阐述理由及相应的科学依据。
查看详情
腔镜用吻合器产品注册技术审查指导原则(2017年第44号)本指导原则旨在为申请人进行腔镜用吻合器产品的注册申报提供技术指导,同时也为食品药品监督管理部门对注册申报资料的审评提供技术参考。本指导原则是对腔镜用吻合器产品注册申报资料的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
查看详情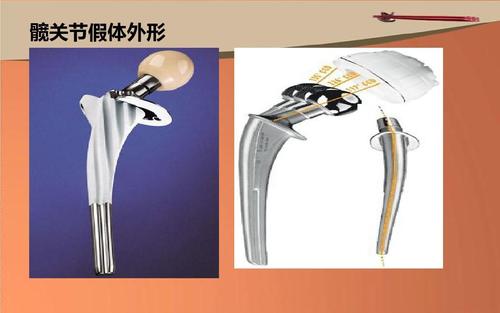
髋关节假体系统注册技术审查指导原则(2017年第23号)本指导原则旨在为申请人进行髋关节假体系统产品的注册申报提供技术指导,同时也为食品药品监督管理部门对注册申报资料的审评提供技术参考。本指导原则系对髋关节假体系统产品注册申报资料的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
查看详情
人工颈椎间盘假体注册技术审查指导原则(2017年第23号)本指导原则旨在为申请人进行人工颈椎间盘假体的注册申报提供技术指导,同时也为食品药品监督管理部门对注册申报资料的审评提供技术参考。本指导原则系对人工颈椎间盘假体注册申报资料的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
查看详情
影像型超声诊断设备(第二类)注册技术审查指导原则(2017年第60号)本指导原则旨在指导注册申请人对第二类影像型超声诊断设备中的灰阶成像系统注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对影像型超声诊断设备的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情
电动牵引装置注册技术审查指导原则(2017年修订版)(2017年第60号)本指导原则旨在指导注册申请人对电动牵引装置注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对电动牵引装置的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情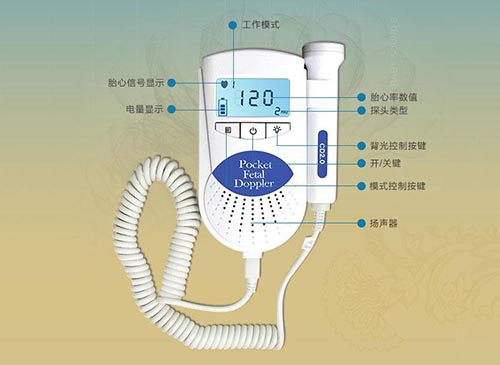
超声多普勒胎儿心率仪注册技术审查指导原则(2017年第60号)本指导原则旨在指导注册申请人对超声多普勒胎儿心率仪产品注册申报资料的准备和撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对超声多普勒胎儿心率仪的一般技术要求,注册人应依据具体产品的特性对注册申报材料的内容进行充实和细化。
查看详情
牙科种植机注册技术审查指导原则(2017年第124号)本指导原则旨在指导申请人提交牙科种植机的注册申报资料,同时规范牙科种植机的技术审评要求。本指导原则是对牙科种植机的一般性要求,申请人应根据牙科种植机的特性提交注册申报资料,判断指导原则中的具体内容是否适用,不适用内容详述理由。申请人也可采用其他满足法规要求的替代方法,但应提供详尽的研究资料和验证资料。
查看详情