24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

国内医疗器械行业从业者对于MDSAP认证相对陌生,就企业如何申请MDSAP认证及相关事项,飞速度在此为广大客户朋友们总结、说明。
查看详情
最近两年,常有客户询问到MDSAP认证相关事宜,申请并通过MDSAP认证对医疗器械出口企业有诸多好处,因此,飞速度撰文为大家科普一下。
查看详情
注册证是进入市场的入场券。在我国,第二、三类医疗器械要投入销售、使用,须先按照《医疗器械注册管理办法》或《体外诊断试剂注册管理办法》的相关规定向食药监部门申请产品注册,取得医疗器械注册批件,从而获得进入市场的资格。
查看详情
一、概述 含药医疗器械产品是一种由药物和医疗器械组成并以医疗器械起主要作用的新型医疗器械产品。由于该类产品大多具有风险高,技术性能复杂,涉及知识领域广泛,影响产品性
查看详情
药物、器械、生命支持营养是普遍认同的疾病预防、治疗的三大领域。相比营养,药械组合产品在研究和临床应用上更加普遍和成熟,预期未来应用会更多。本文为大家科普药械组合产品注册申报流程。
查看详情
2020年10月10日,审评中心发布有关医疗器械注册?相关答疑,为大家解答有关灌流器产品需要控制哪些可沥滤物问题。
查看详情
进口医疗器械注册与国产医疗器械注册既有区别又有相同点,关于进口医疗器械注册是否需要检验,检验的要求与国产医疗器械注册检验有无差异,在哪来检验,本文为您介绍。
查看详情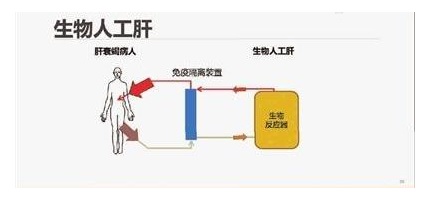
目前全球新型冠状病毒肺炎(COVID-19)疫情防治工作进入攻坚阶段,重型、危重型患者的有效救治是降低病死率的关键。人工肝血液净化系统可以清除炎症因子,减轻炎症反应对机体的损伤,对重型、危重型患者的救治具有重要临床意义。
查看详情