24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

11月13日,国家药品监督管理局(NMPA)正式批准推想医疗科技股份有限公司(原北京推想科技有限公司,简称推想科技)的肺结节AI三类认证,这也是中国NMPA批准的第一张肺部AI三类认证。早在2020年初,推想就以全球第一家的身份拿到胸肺CT领域AI的FDA和PMDA认证,至此,推想科技也成为全世界唯一一个拥有欧盟CE、日本PMDA、美国FDA,中国NMPA四大市场认证的AI医疗公司,获得了全球绝大部分主要医疗市场的准入资格。
查看详情
To help you enhance your writing, we present four useful tips based oncommonly found errors、You can place the next few points right into practice!为了帮助大家编写方案,我们根据普遍发现的问题向大家推送了4条有用的技巧,供大家参考。
查看详情
第一次出访医院拜访主研,总会畏手畏脚。不知道这样做对不对,虽然SeniorCRA告诉你流程是这样,“怕”是人之常情,凡事熟能生巧,有第一次的磨炼才有后续的精通。下面将本人首次CRA监查工作经验和收获分享给大家。
查看详情
润滑剂类产品在美国根据产品预期用途的不同主要分为人体润滑剂和患者润滑剂:其中,人体润滑剂主要成分为水、丙二醇、羟乙基纤维素、苯甲酸、卡波姆、氢氧化钠等,作用于生殖器,起滋润作用。该类产品在FDA的分类为Ⅱ类,认证途径为510K(Premarket Notification上市前通告)以及产品列名。产品代码为:NUC。
查看详情
为了贯彻落实《国务院关于支持自由贸易试验区深化改革创新若干措施的通知》“将台湾地区生产且经平潭口岸进口的第一类医疗器械的备案管理权限下放至福建省药品监督管理部门”的规定,现将经国家药品监督管理局批复同意的《福建省药品监督管理局承接台湾地区生产且经平潭口岸进口第一类医疗器械备案工作方案》(见附件)予以通告。
查看详情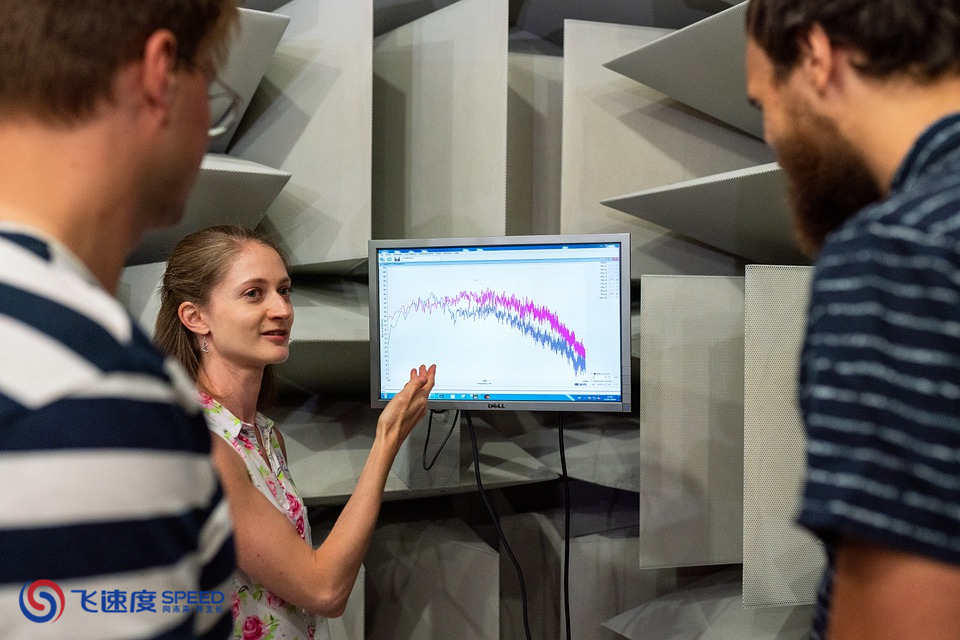
一类医疗器械生产企业需要办理哪些证件?我国对医疗器械实行分类管理制度,一类医疗器械生产企业需要办理第一类医疗器械备案凭证及第一类医疗器械生产备案凭证,我们一起来看一下第一类医疗器械生产备案凭证图片。
查看详情
中国是世界上最多人口的国家,是全球最大的医疗器械新兴市场之一,全球资本及优质医疗器械服务商纷纷加大对中国医疗器械市场的关注和投入。经常会有人打电话咨询,说他们有一个进口产品,能不能在中国做注册。相信很多进口代理商都有这样的疑问,接下来我为大家详细解释一下什么是进口医疗器械注册?进口注册的首要条件是什么?
查看详情
我想在郑州中原区开一家店卖三类医疗器械产品,需要办理哪些证件?医疗器械划分为三类,经营三类医疗器械需要办理营业执照和三类医疗器械经营许可证,三类医疗器械经营许可证需向药监部门审核,先来看看三类医疗器械经营许可证图片。
查看详情