24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
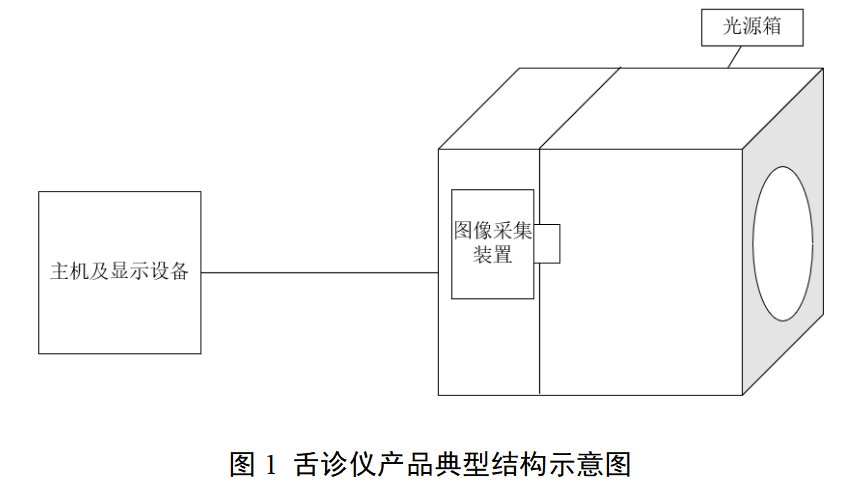
本指导原则旨在指导注册申请人对中医舌诊设备注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对中医舌诊设备的一般要求,申请
查看详情
本指导原则旨在为医疗器械注册申请人进行地高辛检测试剂的注册申报提供技术指导,同时也为医疗器械监督管理部门对注册申报资料的审评提供技术参考。 本指导原则是对该
查看详情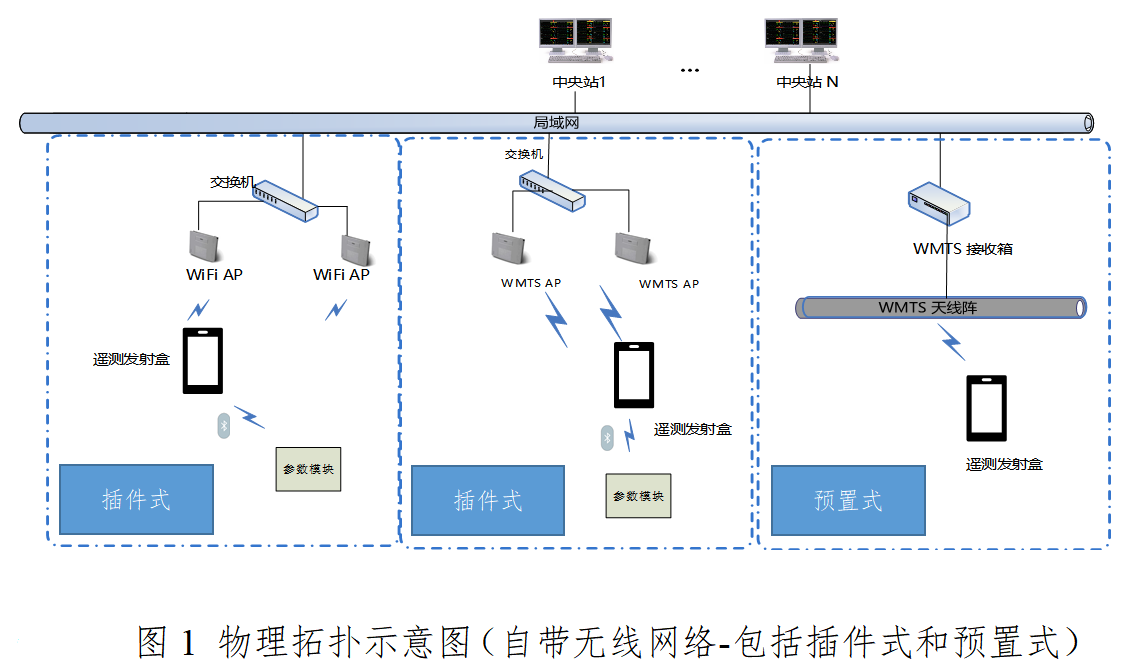
本指导原则旨在指导注册申请人对遥测监护系统注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供参考。 本指导原则是对用于遥测监护系统产品的
查看详情
本指导原则旨在为医疗器械注册申请人进行丙戊酸测定试剂的注册申报提供技术指导,同时也为医疗器械监督管理部门对注册申报资料的审评提供技术参考。 本指导原则是对该
查看详情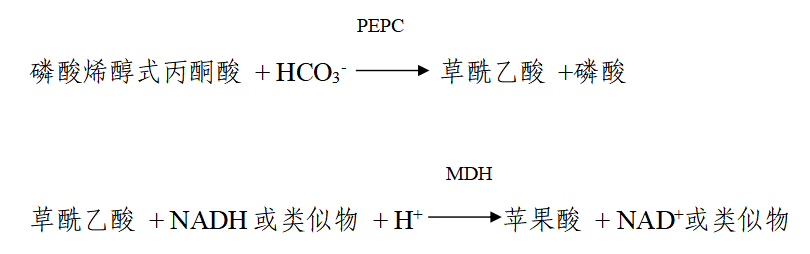
本指导原则旨在为医疗器械申请人进行二氧化碳测定试剂的注册申报提供技术指导,同时也为医疗器械技术审评部门提供技术参考。 本指导原则是对二氧化碳测定试剂注册申报
查看详情
本指导原则旨在指导注册申请人对立式压力蒸汽灭菌器注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对立式压力蒸汽灭菌器的
查看详情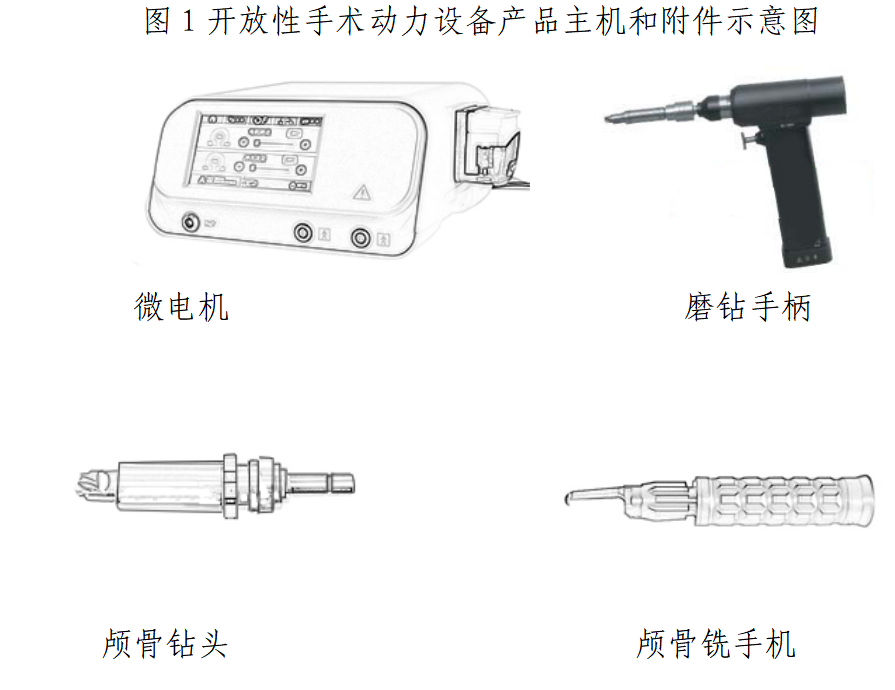
本指导原则旨在指导注册申请人对手术动力设备注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对手术动力设备的一般要求,申请
查看详情
本指导原则旨在指导注册申请人对钙磷/硅类骨填充材料注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供技术参考。 本指导原则是对钙磷/硅类骨
查看详情