24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
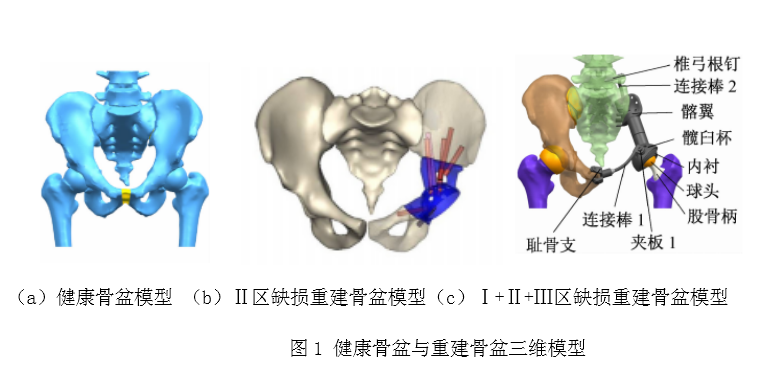
生物医用材料又称为“生物材料”,是诊断、治疗、修复或替换人体组织或器官,或增进其功能的一类高技术新材料。3D打印技术又称为“快速成型技术”或&
查看详情
膝关节假体是一种常见的骨科植入物,用于替换因疾病或损伤而丧失功能的膝关节。随着人口老龄化趋势的加剧,膝关节置换手术的需求日益增加。膝关节假体主要分为全膝关节假体
查看详情
引言 医疗器械注册人制度是中国医疗器械监管领域的一项重要改革,旨在鼓励创新、优化资源配置并提高医疗器械的质量和安全性。随着这项制度在全国范围内的全面实施,越来越
查看详情
引言 体外诊断试剂(IVD)在现代医学中扮演着至关重要的角色,它们可以帮助医生和研究人员快速准确地诊断疾病、监测治疗效果等。随着科学技术的发展,体外诊断试剂的种类和应
查看详情
医疗器械的研发和验证是确保其安全性和有效性的关键步骤。对于像导管三尖瓣置换器械这样的高端医疗器械来说,动物试验是评估其性能和生物相容性的重要环节之一。然而,有时
查看详情
2024年1月8日,美国FDA发布《无菌类器械上市前通知(510(k))申报资料中关于无菌证明资料的递交及审查》指南文件。该指南文件阐明在无菌类器械510(k) 申报资料中应包括的灭
查看详情
程序性死亡配体1(PD-L1)是程序性死亡受体1(PD-1)的主要配体,为Ⅰ型跨膜蛋白,参与细胞调节和免疫反应,广泛表达于抗原提呈细胞和非淋巴组织等。PD-1/PD-L1通路的阻断现已证
查看详情
医疗器械在医疗保健领域扮演着至关重要的角色,其设计、生产、注册和监管流程均需遵循严格的法律法规。当医疗器械注册证即将到期,或在有效期内产品名称发生变更时,注册人需
查看详情