24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
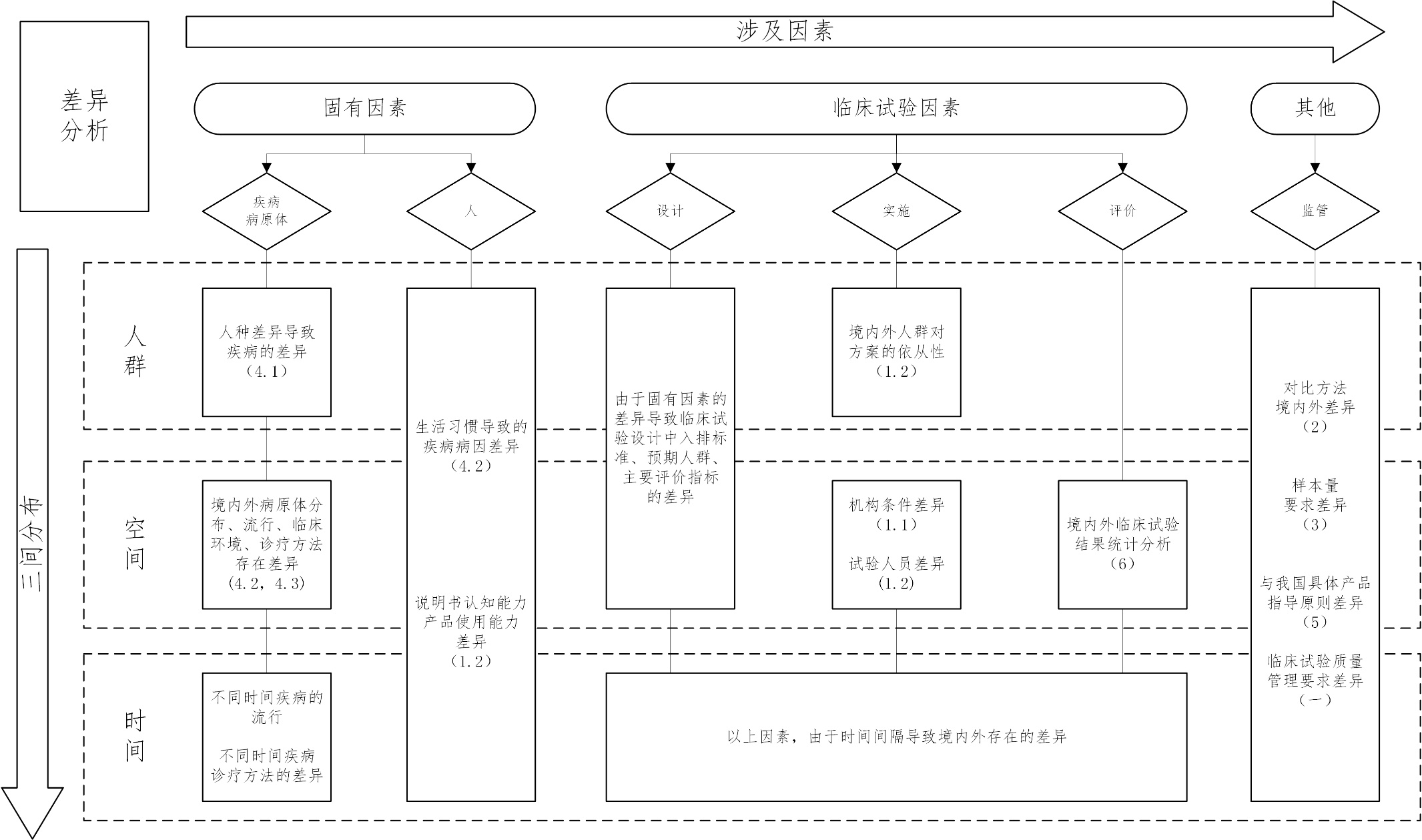
使用体外诊断试剂境外临床试验数据的注册 审查指导原则 为避免或减少重复性临床试验,促进医疗器械技术创新,加快医疗器械在我国的上市进程,更好地满足公众对医疗器械
查看详情
2021年12月31日消息,NMPA对外发布《第一类医疗器械产品目录》。据悉,《第一类医疗器械产品目录》自2022年1月1日起正式施行。液体膏状敷料将不能按照一类医疗器械备案申报。
查看详情
?为贯彻落实国家药监局于2021年9月印发的《关于做好第二批实施医疗器械唯一标识工作的公告》,浙江省药品监督管理局、浙江省卫生健康委员会、浙江省医疗保障局三部门联合印发《浙江省推进实施医疗器械唯一标识 (UDI)工作方案》。
查看详情
什么情形下可提交医疗器械说明书更改告知审查申请?
答:依据《医疗器械说明书和标签管理规定》第十六条,不属于变更注册范围内的说明书其他内容发生变化的,应当向医疗器械注册的审批部门书面告知,并提交说明书更改情况对比说明等相关文件。
我中心收到说明书更改告知审查申请后将参考立卷审查要求对说明书更改告知申请的技术内容进行审查。审查过程中发现申请内容涉及需要注册人提供相应支持性资料的,将发出受理补正通知,明确写明该申请存在的具体问题和需要注册人提交的资料。对于经审查认为不属于说明书更改告知范围的,将在受理补正通知中向注册人明确不符合的具体内容和理由,以及按照变更注册办理的途径。
国家市场监督管理总局令第47号
《医疗器械注册与备案管理办法》已经2021年7月22日市场监管总局第11次局务会议通过,现予公布,自2021年10月1日起施行。 局长 张工 20

增材制造口腔修复用激光选区熔化 金属材料注册审查指导原则
本指导原则旨在指导注册申请人对增材制造口腔修复用激光选区熔化金属材料注册申报资料的准备及撰写,

增材制造金属植入物理化性能 均一性研究指导原则 增材制造(也称三维打印、3D打印)是一个涉及多物理场相互耦合作用的制造过程,其制造产品的质量稳定性受较为复杂且
查看详情
2022年2月进口第一类医疗器械产品备案信息 序号 产品名称 备案号 备案人名称原文 生产地址原文 备案日期 状态 1 全自动样品处理系统 国
查看详情