24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
序号 标准号 标准名称 发布日期 实施日期 归口单位 发布公告 1 YY/T 0061-2021 特定电磁波治疗器 2021-03-09 2023-05-01 全国医用电器
查看详情
序号 标准号 标准名称 发布日期 实施日期 归口单位 发布公告 1 GB 9706.202-2021 医用电气设备第2-2部分:高频手术设备及高频附件的基本安全和
查看详情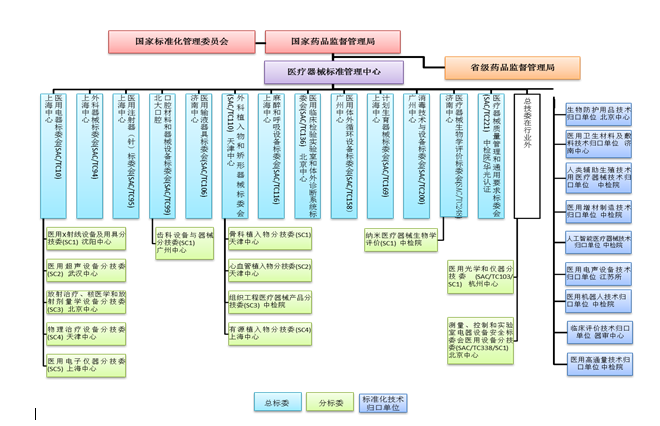
2021年,国家药监局坚持以习近平新时代中国特色社会主义思想为指导,把握新发展阶段,贯彻新发展理念,以推动高质量发展为主题,以规范管理为切入点,严格落实“最严谨的标准&
查看详情
规则的制定,多是事件的催生;规则的出台,多是对社会关系的规范或调整。,为有效预防、及时控制和消除突发公共卫生事件的危害,确保突发公共卫生事件应急所需医疗器械尽快完成审批,2021年12月30日,药监总局发布《医疗器械应急审批程序》的公告(2021年第157号),程序自发布之日起施行。
查看详情
对于无菌医疗器械注册?来说,与产品直接接触的无菌医疗器械的初包装材料,在生产质量管理体系中应如何对其进行有效控制?初包装材料如何控制呢?一起了解一下。
查看详情
《医疗器械监督管理条例》(国务院令第650号)第十条规定:向我国境内出口第一类医疗器械的境外生产企业,由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交备案资料和备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。备案资料载明的事项发生变化的,应当向原备案部门变更备案。这是我国对进口第一类医疗器械产品备案的法规要求。
查看详情
医疗器械注册质量管理体系是什么?是YY/T0287idtISO13485吗?是医疗器械生产质量管理规范吗?听过我讲课的朋友们应该都清楚,医疗器械注册质量管理体系是YY/T0287与ISO13485,及法规要求、客户要求、产品特点和工艺特点等的融合。今天,从另一个视角,为大家介绍有关医疗器械注册体系核查的其它方面知识.
查看详情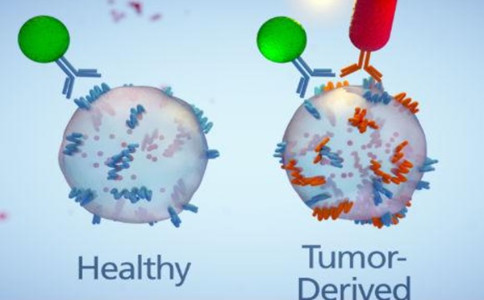
生物标志物(Biomarker)是指可以标记系统、器官、组织、细胞及亚细胞结构或功能的改变或可能发生的改变的生化指标,具有非常广泛的用途。生物标志物可用于疾病诊断、判断疾病分期或者用来评价新药或新疗法在目标人群中的安全性及有效性。
查看详情