24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
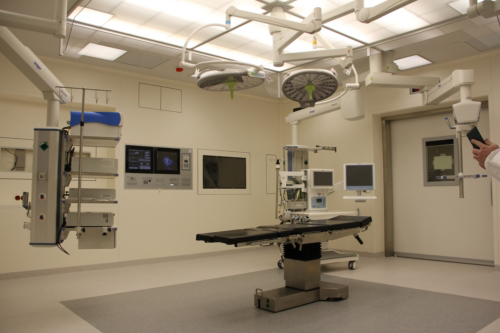
医疗器械临床试验是指获得医疗器械临床试验资格的医疗机构对申请注册的医疗器械在正常使用条件下的安全性和有效性按照规定进行试用或验证的过程,目的是评价受试产品是否具有预期的安全性和有效性。
查看详情
2021年6月30日,海南省海南省发展和改革委员会、海南省财政厅联合发布《关于免收和降低药品注册与医疗器械产品注册收费有关事项的通知》,海南小微企业免收医疗器械产品首次注册费。
查看详情
2021年8月26日,为加强医疗器械产品注册工作的监督和指导,进一步提高医疗器械注册审查质量,国家药品监督管理局组织制定了《应用纳米材料的医疗器械安全性和有效性评价指导原则第一部分:体系框架》,详见正文。
查看详情
试验用医疗器械的管理是否规范直接影响到临床试验结果及受试者安全,关系到医疗器械的科学有效评价。为贯彻落实《中共中央办公厅 国务院办公厅印发<关于深化审评审批制度改革鼓励药品医疗器械创新的意见>的通知》(厅字﹝2017﹞42号)要求,推进医疗器械临床试验学科建设,形成监管长效机制,我局发布实施《北京市临床试验用医疗器械管理指南》,进一步规范对试验用器械在临床试验前准备、临床试验实施过程中及临床试验结束后的回收处理等环节管理要求,指导北京市医疗器械临床试验用医疗器械规范管理。
查看详情
目前医疗器械监管工作对于通用名称提出较高的要求,无论是上市前审评、上市后监管还是对于生产企业而言,都面临着相当大的压力和一定的困难。现就医疗器械通用名称的意义、要求以及所面临的问题做如下分析,以期对医疗器械监管工作提供参考建议。
查看详情
提到电气安全和电磁兼容,大家可以比较熟悉的是9706.1和YY0505这两个标准,但是,器械类别和特性不同,适用的标准存在差异。另外,近期公司个别同事在22大类有源医疗器械检测标准适用性方面工作疏忽,因此,写个小文章避免大家踩坑。
查看详情
有义乌客户问到这个,公开能查询到的是2020年底发布的,义乌市经信局关于征求《关于加快推动生物医药产业高质量集聚发展的若干政策》意见的公告中关于取得医疗器械注册证奖励政策,供朋友们参考。
查看详情
清热解毒口服液中灰毡毛忍冬皂苷乙
检查项补充检验方法
(BJY 202205)【检查】 灰毡毛忍冬皂苷乙 照高效液相色谱法(中国药典2020年版通则0512)测定。
色谱条件与系统适用性试验