24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

某项目经过受试者知情入组后,在进行到第一周期随访时,查看受试者日记卡时发现日记卡上内容均没有进行填写,仔细询问受试者发现受试者是文盲,只会写自己的名字和简单数字。当再和受试者及家属进行沟通后,表示之前不清楚临床试验的意义。考虑到风险想要退出试验,经了解后得知,知情过程中研究者刚刚和受试者交待完项目涉及的主要内容。因为科室有事,研究者被护士叫走,半小时后研究者回来,简单询问受试者是否看明白了,受试者表示明白。研究者让受试者在指定位置签字、签日期,后面按流程进行了相关筛选及随访事宜,然而实际受试者并没有看懂及理解知情同意书内容,因为“不好意思”故未承认自己不识字。
查看详情
某乳腺癌项目012号受试者,基线期血小板计数降低II级,研究者判断有临床意义,并将血小板计数降低记录在病史之中。C2D15周期用药前实验室检查显示恢复了正常水平,然后在C3D1周期用药前又出现血小板计数降低II级。研究者判断血小板计数降低II级记录为AE(如下图),并且在病历中记录该AE与试验药物可能相关。CRC根据病历记录将AE信息录入EDC系统,在某次监查的时候,CRA发现该AE与研究药物相关性在EDC中的数据与化验单上数据不一致。研究者在化验单上评估该AE与试验药物无关,与研究者沟通后,研究者反馈考虑受试者基线有血小板计数降II级,所以判断无关。CRC提出原始记录为与药物可能相关,研究者根据实际情况进行原始资料修改与补充说明,CRC后续也将EDC中的数据做出了修改。
查看详情
相信通过标题读者已经猜到今天我们要聊的话题——交接。临床试验行业人员流动性很大,且项目周期都较长,在CRA的工作中不可避免会涉及到项目交接。不管交接者(A)出于什么原因提出交接,被交接者(B)心里应该都会咯噔一下。有时新人刚入行过了试用期就要面临交接的问题,心里肯定更是没谱了。看过一些讨论交接的文章,大多是没有干货的吐槽。那么今天笔者就通过自己的被交接与交接经验,说一说如何做好交接工作,成为在被交接者心中的“最佳前任”。
查看详情
GMP洁净室施工各流程的注意要点!基本要求1、承担洁净厂房工程的施工企业,应具有相应工程施工资质及其等级,并应具有完善的质量管理体系。洁净厂房的施工应按设计文件、合约的内容实施。当修改设计时,应经原设计单位的确认、签证,并得到建设单位的同意。洁净厂房施工前应根据具体工程项目的特点,制订施工方案和程序,做到各工种协调施工、阶段明确、交接清楚,确保整体施工质量和安全操作。
查看详情
近日美国食品药品监督管理局(FDA)更新了《医疗器械提交的反馈申请和会议申请:Q-Submission指导原则》。此文件是对2019版Q-sub指导原则的更新,更新的主要内容如下:1. 增加了STeP医疗器械安全技术计划的Q-Sub形式;海河在1月8日发布的公众号文章已经和大家分享了FDA新的审核项目STeP。本次Q-Sub指导原则的更新也是为配套新的审核项目提供的新的反馈机制。2. 增加了信息会议此类Q-Sub其他适用形式的举例。
查看详情
CRA如何有效监查ICF?CRA在医院做监查时,ICF是非常重要的监查内容。这里列出监查时常见注意事项谨供讨论:
查看详情
一个产品带有CE 标志(标记) 也就意味着其制造商宣告:该产品符合欧洲的健康、安全、与环境保护之相关法律中所规定 的基本要求。因而该产品是对:使用者(译者注:人)、宠物(译者注:家畜家禽)、财产(译者注:物业)、及环境(译者注:自然环境)都安全的产品。
查看详情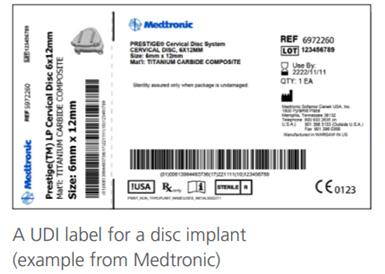
2020年8月,欧盟委员会发布了MDR和IVDR法规下对于UDI系统使用的常见问题解答,小编对其梳理和总结如下:
查看详情