24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

人类遗传资源行政许可申报流程及审批时限申报流程:(1)科技部收到申请人在线提交的电子版申请材料后,在5个工作日内完成审查。对申请材料齐全、符合规定形式的,通知申请人打印纸质材料;申请材料不齐全或不符合要求的,通过网上申请平台一次性书面告知申请人需要补正的全部内容。(2)申请人将网上预受理的电子版申请材料打印后,经申请单位审核盖章后,按隶属关系报国务院有关部门或省级科技行政部门,国务院有关部门或省级科技行政部门审核申请材料的真实性并加盖部门公章,申请单位向科技部递交纸质申请材料。
查看详情
“涉及人类遗传资源的国际合作项目审批”行政许可名称变更为“人类遗传资源采集、收集、买卖、出口、出境审批”后,审批工作有何不同?对申报单位和国际合作有何影响?涉及人类遗传资源国际合作的审批范围、条件与更名前一致,没有任何变化。更名后的行政许可工作,对国内机构开展的涉及重要遗传家系和特定地区的采集、以保藏为目的的收集进行了细化管理。
查看详情
发布《人类遗传资源采集、收集、买卖、出口、出境审批服务指南》的原因?为加强我国人类遗传资源的规范化管理,有效保护和合理利用我国人类遗传资源,促进平等互利的国际科技合作交流,1998年国务院办公厅转发了《人类遗传资源管理暂行办法》(国办发[1998]36号,以下简称《暂行办法》),依据《暂行办法》设定了“涉及人类遗传资源的国际合作项目审批”行政许可审批事项。
查看详情
2020器审中心答疑汇总Q1:软性接触镜产品如何延长产品的货架有效期?A:因现有注册证及其附件已经载明了软性接触镜产品的货架有效期,应按照许可事项变更程序进行变更。建议参照GB/T 11417.8-2012《眼科光学 接触镜第8部分:有效期的确定》开展货架有效期研究。申报时需提供完整的实时老化研究报告。
查看详情
目前总结最全的肿瘤系统全称缩写及中英文对照版,分享给大家。
查看详情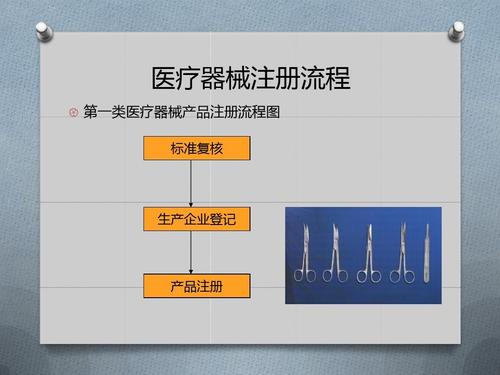
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2020年第147号)于元旦前夕发布,成了器械圈节日里最关注的话题。触动着每位注册人的神经,因为不论在中国还是美国、欧盟地区,不同的产品的分类对应不同的合规路径。先介绍一下近日的发布稿,与国家药监局综合司公开征求《医疗器械分类目录》内容调整意见(2020-03-20)中发布的征求意见稿的区别。《医疗器械分类目录产品管理类别调整意见汇总表》,共15类医疗器械管理类别进行调整(征求意见稿中共16类,其中删除2类,新增1类)。
查看详情
适用于MDR 2017/745法规的下的软件分类应该是困扰大家比较多的事情,今天小编将结合MDCG 2019-11 Qualification and classification of software - Regulation (EU) 2017/745 and Regulation (EU) 2017/746指南为大家说一说,医疗器械软件分类的那些事。
查看详情
目前有3种上市前通知510(k)s可以向FDA提交: 传统(Traditional);特殊(Special); 和 简短(Abbreviated)。“对于确定的、了解清楚的器械种类,基于安全和性能的途径(The Safety and Performance Based Pathway)是简短510(k)途径的一种扩展。在基于安全和性能的途径下,医疗器械制造商可以选择使用FDA认可的有效性标准来证明该器械与进行实质等效比较的器械一样安全有效。使用该途径不会影响FDA通过法规授权获得信息的能力。更多信息,请参阅“基于安全和性能的途径”指导原则。
查看详情