24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

为加强医疗器械分类管理,规范《医疗器械分类目录》动态调整工作,根据《医疗器械监督管理条例》《医疗器械分类规则》,国家药监局起草了《医疗器械分类目录动态调整工作程序(征求意见稿)》,现向社会公开征求意见。请于2020年12月15日前,将意见或者建议以电子邮件方式反馈至mdct@nmpa.gov.cn,邮件主题请注明“医疗器械分类目录动态调整工作程序意见”。
查看详情
医疗器械注册申报流程图一、注册申请资料准备一、注册申报资料依据《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2014年第43号) 二、注册申报相关要求 1、
查看详情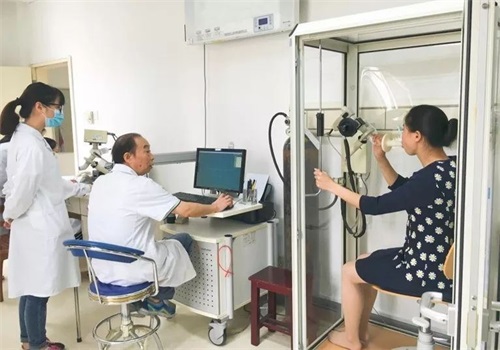
肺通气功能测试产品注册技术审查指导原则旨在指导注册申请人对肺通气功能测试产品的注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则适用于测定肺活量、用力肺活量、最大自主通气量等肺功能通气指标的肺功能测试设备。根据《医疗器械分类目录》(国家食品药品监督管理总局公告2017年第104号),肺功能测试设备的分类编码为07-02-03,管理类别为Ⅱ类。
查看详情
医疗器械临床试验在近年被大家熟知,作为医疗器械上市前重要的一环,其涉及的领域非常广泛,随之产生了各种各样的角色。CRA和DM的接触,基本仅限于在EDC系统中打个照面。CRC稍多一点,或许是因为在质疑上的Battle hhh。现在自己是一名DM,这到底是一份什么样的工作,今天全方位向大家解析这个岗位。
查看详情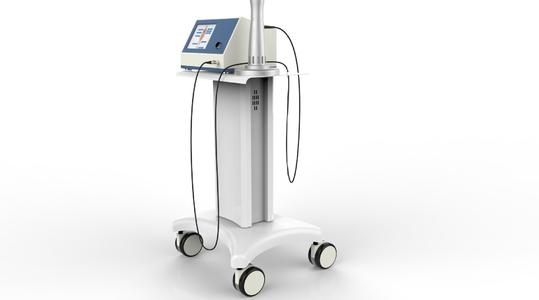
冲击波治疗仪设备注册技术审查指导原则适用于气压弹道式的冲击波治疗仪。其他类型的冲击波治疗仪设备可参考本指导原则。根据新《医疗器械分类目录》(国家食品药品监督管理总局公告2017年第104号),分类编码为09(物理治疗器械)—04(力疗设备/器具)—05(冲击波治疗设备)。
查看详情
近期,国家药品监督管理局医疗器械技术审评中心发布了医疗器械注册技术审查指导原则编制计划,包含86个医疗器械产品注册审查技术指导原则。
查看详情
近期,浙江省药品监督管理局发布了2018年医疗器械经营企业飞行检查情况通报,结果不容乐观。
查看详情
目前,国家对经营第一类医疗器械的企业,既不要求备案,也不要求许可,全面放开;对经营第二类医疗器械的企业,则要求向市级进行备案;对经营第三类医疗器械的企业,要求必须获得医疗器械经营许可证。为保障医疗器械产品经营过程中的质量安全,国家要求在医疗器械采购、验收、贮存、销售、运输、售后服务等环节均需符合GSP规定。从事第三类医疗器械经营的企业还应当具有符合医疗器械经营质量管理要求的计算机信息管理系统。那么,什么是医疗器械GSP软件呢?飞速度给您解答如下:
查看详情