24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

在完成了生物类似药的药学研究以及非临床研究后,即进入生物类似药的临床研究阶段。临床研究的一般考虑 生物类似药的临床研究亦遵循生物类似药的整体开发原则,通过开展
查看详情
2023年7月10日,四川省卫生健康委印发了《四川省二级综合医院评审操作手册(2023年版)》(以下简称《操作手册》)。现对有关要点解读如下。一、修订背景 2022年12月,国家
查看详情
四川省二级综合医院评审操作手册 (2023年版)
为指导二级综合医院加强日常管理和质量持续改进,按照国家卫生健康委二级医院可参照使用三级标准的规定,我委依据《三

医疗器械注册核查是确保医疗器械质量与安全性的一项重要步骤。对于有源产品,特别是生物安全柜等三类医疗器械,其生产现场体系考核显得尤为关键。本文将深入解析这一过程,以帮助
查看详情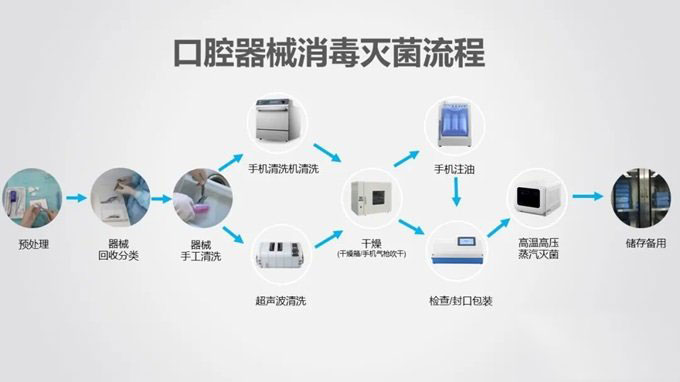
由于口腔科诊疗操作的特殊性,口腔医疗机构很容易成为交叉感染的重灾区,那么口腔医院是如何做好器械消毒,保护好医护和患者的安全呢。接下来就带大家了解口腔科器械消毒的流
查看详情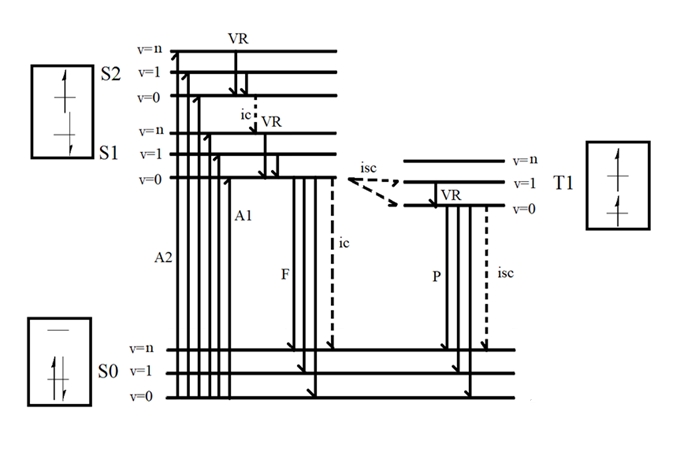
分子荧光光度法在药物分析中具有很高的应用价值。它能够实现对微量物质的检测和定量分析,具有很高的选择性和灵敏度,在药物分析中应用广泛。一、分子荧光产生的机理 1.
查看详情
真实世界研究(real-world study,RWS)起源于药物上市后评价的实用性临床研究,开始时是指药物在实际临床实践中应用的进一步评价。此时,可能将药物应用于各类不同情况或状态
查看详情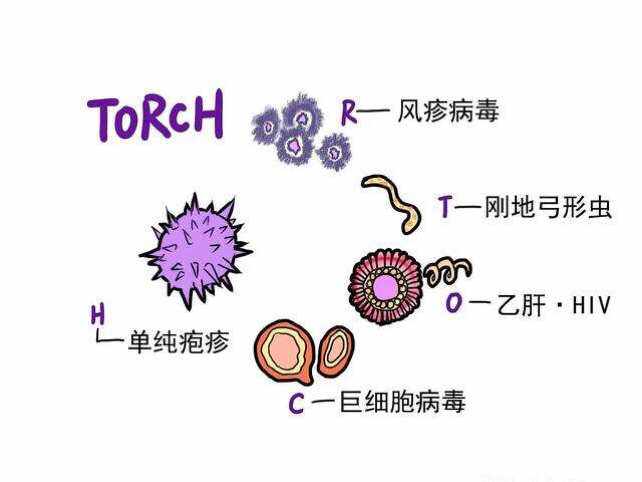
本指导原则旨在指导注册申请人对弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒抗体及G型免疫球蛋白(Immunoglobulin G, IgG)抗体亲合力检测试剂注册申报资料的准备及撰写
查看详情