24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

近年来,随着医学技术的飞速发展,腹腔内窥镜手术系统在泌尿外科手术中的应用逐渐引起了人们的关注。为了更全面、科学地评估内窥镜系统在泌尿外科手术中的安全性和有效性,一
查看详情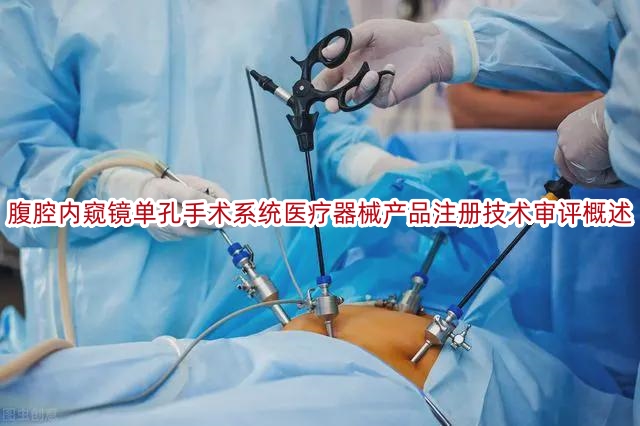
产品概述(一)产品结构及组成产品由医生控制台、患者手术平台、三维电子腹腔内窥镜、 手术器械及附件组成。(二)产品适用范围该产品由医师利用主从操控系统对于微创手术器械进行
查看详情
本指导原则旨在指导注册申请人对软性内窥镜用高频手术器械注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对软性内窥镜用高
查看详情
医疗器械的使用期限和失效日期,作为保障其安全性和有效性的两大重要指标,自2014年开始被我国《医疗器械监督管理条例》明确规定,对医疗机构和使用者来说都具有至关重要的意
查看详情
强制降解试验属于药品稳定性研究的内容之一,是研发分析人员在质量研究过程中无法绕开的一个话题。强制降解试验如能够合理、高效的开展,将为产品的研发以及生产检验提供极
查看详情
一、妇科阴道凝胶类产品适用范围应如何规范描述? 一是妇科凝胶类产品适用范围应符合《医疗器械监督管理条例》所规定的医疗器械定义的情形。 二是妇科凝胶类产品适用
查看详情
医疗器械是医疗行业的重要支柱,而它们的合法上市与注册息息相关。国内医疗器械注册流程严格而繁琐,包括产品立项开发、医疗器械分类、注册检验、临床评价、注册资料准备、
查看详情
前言导读 FDA突破性设备认证(Breakthrough Devices Program)是美国食品药物监督管理局(FDA)设立的一个项目,旨在更快地将那些为了更有效地治疗或诊断生命威胁或不可逆
查看详情