24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

一、目的 为指导流式细胞仪配套用体外诊断试剂产品管理属性和管理类别判定,根据《医疗器械监督管理条例》和《体外诊断试剂分类规则》制定本原则。二、范围 本原则中的
查看详情
随着医疗科技的不断进步,医疗器械在医疗实践中发挥着越来越重要的作用。然而,医疗器械的安全性和有效性直接关系到患者的生命健康,因此对其质量的监测尤为重要。在医疗器械
查看详情
什么是医疗器械的人因设计 : 也叫可用性工程,人因工程,是运用人类心理、生理等理论知识,设计医疗器械!使医疗器械更符合人的特性,保障医疗器械的安全有效使用的过程。为什么
查看详情
本指导原则旨在指导注册申请人建立医疗器械人因设计过程和准备医疗器械人因设计注册申报资料,同时规范医疗器械人因设计技术审评要求。 本指导原则是对医疗器械人因设
查看详情
药物In-use stability testing或称为使用中稳定性试验,通过模拟产品实际使用场景,对关键指标如物理、化学、微生物学/生物学等参数进行研究,证明随着时间的推移,在温度、空
查看详情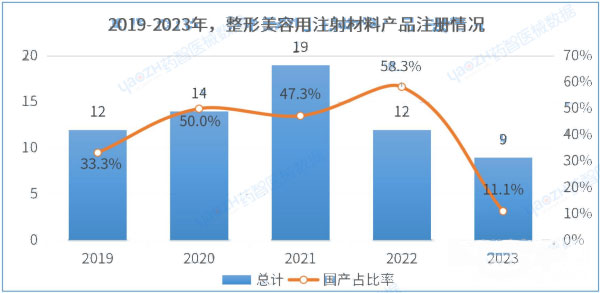
自2020年新冠疫情爆发以来,国家对医疗器械行业发展重视程度显著提高,在政策方面给予较大支持。国家鼓励创新,从加快器械审批流程、财政税收支持、采购优先选择国货和出台国
查看详情
医疗器械行业标准是为了保障医疗器械的质量、安全、有效性以及在生产、运输、使用等环节中的合规性而制定的一系列技术规范和要求。以下是10元开始实施的医疗器械行业标准:1
查看详情
案情 2023年6月,A省药检院在B药品生产企业仓库对其使用的C企业生产的口服固体药用高密度聚乙烯瓶(以下简称聚乙烯瓶)进行抽检,检验报告显示该口服固体药用高密度聚乙烯瓶&
查看详情