24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

医疗器械检验需要进行一系列准备工作,以确保检验顺利进行并达到预期目标。以下是一些常见的准备工作: 检验申请:根据检验的目的和要求,准备相应的检验申请书和检验计划
查看详情
1、本文收录的融资事件仅统计一级市场,涵盖以医疗器械为主营业务的研发、生产、专业服务、医学检验等相关企业; 2、本文收录的融资事件数据统计时间区间为2022年1月1
查看详情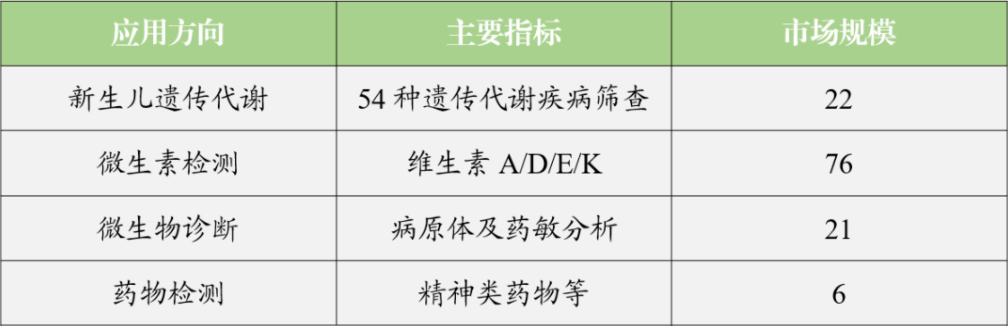
体外诊断行业最大的机遇源自新冠三年,各大细分市场出海加速,内循环加快。一、生化诊断市场 从肝功带量申报厂家来看,切入生化诊断领域的厂家是变多了,不是变少了,最大的想
查看详情
药监局在“早期介入、专人负责、科学审查”的原则下可对申报创新医疗器械的产品加快审评进程,创新医疗器械产品的审评较其他产品平均可缩短约83天。对于研发企
查看详情
春天里迎来了中药注册史上一个里程碑文件。 日前,国家药监局发布《中药注册管理专门规定》(以下简称《专门规定》),自2023年7月1日起施行。经过多年酝酿、两次公开征求
查看详情
近日,浙江省医疗器械检验研究院(以下简称浙江省器械院)启动“数字化应用项目(一期)”建设,推动数字化建设与检验检测服务的深度融合,打造具有器械检验辨识度的数
查看详情
在中国,医疗器械被分为三类,分别是一类、二类和三类医疗器械。其中,一类医疗器械是指对人体进行诊断、治疗和预防疾病的低风险医疗器械,不需要进行临床试验,但仍需进行严格的
查看详情
医疗器械注册证是指国家药品监督管理局依法核发的医疗器械产品注册证书。它是医疗器械企业获得医疗器械生产许可证之后,进行市场销售和使用的必备证件之一。医疗器械注册证的
查看详情