24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

在多年的医疗器械注册行业从业经历中,补正不是或有事项,是必然事项。本文为大家介绍上海疫情期间医疗器械注册?补正资料递交及相关问题答疑。
查看详情
近日,国家药品监督管理局调整《医疗器械分类目录》,调整了09-07-02射频(非消融)治疗设备的产品描述和预期用途内容,并将射频皮肤治疗仪正式列入医疗器械分类目录,射频皮肤治疗仪也就是我们常说的射频美容仪正式纳入医疗器械管理,企业在生产、进口和销售射频美容仪前应先获得医疗器械注册证。 1. 射频美容仪产品描述 射频美容仪或射频皮肤治疗
查看详情
一、 受理通知书、行政审批省局缴费通知书下载 第二类医疗器械首次注册、第二类医疗器械变更注册、第二类医疗器械延续注册事项申请,在受理中心受理资料之后会相应生成《受理通知书》《行政审批缴费通知书》,各企业可通过接收到的受理或缴费短信通知内的网址登录系统查看下载。使用chrome或360安全浏览器等浏览器急速模式,打开系统网址(http://qcwb.
查看详情
各家认证机构标准的解读,及认证风险防控的差异,对生产医用包材公司是否能申请ISO13485认证事项见仁见智,意见不一。这个事项我们也是与多家认证机构沟通、确认了此事,生产医用包材的企业,及生产医疗器械前端供应链上的企业均可以申请ISO13485认证。如下是SGS及TUV公司颁发的认证证书样本。
查看详情
安徽宣城广德毗邻浙江湖州长兴,政府行政服务非常好,适合医疗器械产业投资、发展。昨天出差到广德,顺道为大家科普一下安徽宣城广德第一类医疗器械产品备案流程和要求。
查看详情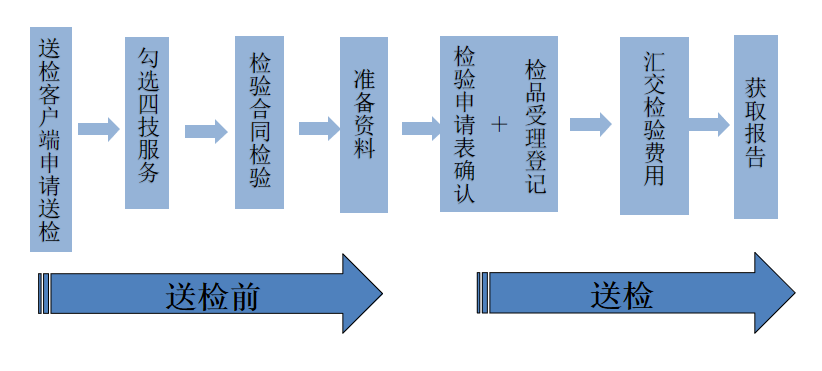
依据《体外诊断试剂注册备案管理办法》及其相关文件规定,新冠抗原检测试剂在临床试验及注册提交前应先完成检测,检测样品可由企业自行送检且现场办理检测流程,中国食品药品检定研究院(NIFDC)的新冠抗原检测试剂的送检流具体流程如下: 鉴于检验能力和国家参考品要求,目前新冠抗原检测试剂注册前检测暂时只能委托中国食品药品检定研究院 1、新
查看详情
新型冠状病毒突变株检出能力评价技术审评要点(2022年第13号),旨在指导注册申请人对2019新型冠状病毒核酸检测类产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
查看详情
2022年医疗器械推荐性行业标准制修订计划项目
序号 项目名称 标准性质建议 制修订 归口单位 项目承担单位 项目号 1 心脏单光子发射计算机断层