24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
依据《体外诊断试剂注册备案管理办法》及其相关文件规定,新冠抗原检测试剂在临床试验及注册提交前应先完成检测,检测样品可由企业自行送检且现场办理检测流程,中国食品药品检定研究院(NIFDC)的新冠抗原检测试剂的送检流具体流程如下:
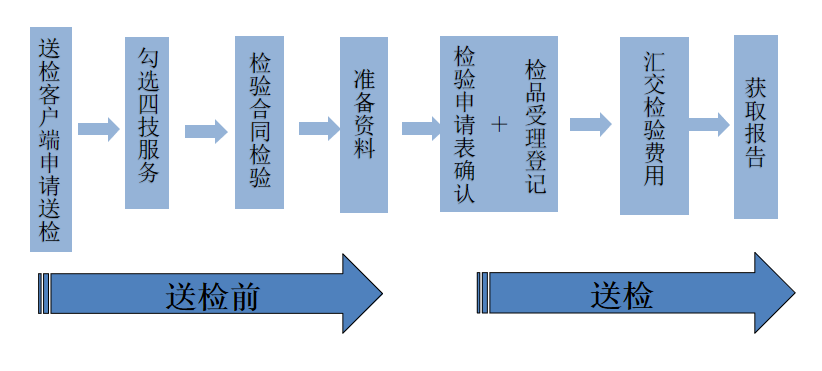
鉴于检验能力和国家参考品要求,目前新冠抗原检测试剂注册前检测暂时只能委托中国食品药品检定研究院
1、新冠抗原检测试剂首次注册检测前资料要求:
(1)申请单位出具的检验申请函,加盖申请单位公章;检验申请表(请登记联系人电话和E-mail信息);
(2)证明文件:申请人企业许可证(复印件),提交资料真实性的声明。
(3)产品说明书;
(4)拟定申报产品技术要求;
(5)分析性能评估资料;
(6)阳性判断值确认资料;
(7)自检报告。
2、新冠抗原检测试剂注册检测的样品要求
(1)样品数量要求:一般情况下,样品数量应为一次检验用量的三倍。新冠抗原检测试剂请按照三倍检验量(3x60人份)送样(每批次),以最小包装计算。如最小包装为25人份/盒,则单次检验量为3盒=75人份,三倍检验量为9盒,以此类推。
(2)样品状态要求:样品应包装完整,有说明书和完整标签,标签内容应符合国家局体外诊断试剂标签说明书相关文件规定,无正规标签的样品,必需贴有临时标签。标签内容至少包括:检品名称、批号、规格、生产单位;已确定效期的样品标签上应注明效期,有特殊储存条件要求的,标签上需注明储存条件。样品标签内容必须与资料相应内容一致。
国内新冠抗原检测试剂盒可以由企业自行送检,样品应封签完整无损,签名或盖章清晰可辨。
(3)样品效期要求:样品效期一般应满足2个检验周期,除特殊情况外(如进行稳定性考察),已过效期或效期内不能满足2个检验周期的样品不予受理。
3、送检登记注意事项
(1)送检时请携带一式四份(最少)合同。
(2)送样办理检验申请手续的人员需详知送检目的,熟悉样品特性,了解资料内容及新冠抗原检测试剂注册有关规定,能正确填写检验申请表,能对填写的内容负责。在受理登记后核对申请检验登记表各项内容,确认无误后签字或盖章,同时索要检品受理回执并妥善保存,以作为查询、领取报告的凭证。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。