24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

为加强医疗器械临床试验监督管理,国家药品监督管理局采用回顾性检查方式,每年对在审项目的医疗器械临床试验实施监督检查,以确保医疗器械临床试验数据真实和完整。本文总结了 3 年来医疗器械临床试验监督抽查基本情况和我国医疗器械在临床试验过程中存在的主要问题,旨在强化申请人和临床试验单位对临床试验质量的重视,提高临床试验水平,进而提升我国医疗器械研发水平。
查看详情
医疗器械临床试验指在国家认可的医疗器械临床试验机构中,拟对申请注册的医疗器械在正常使用条件下的安全性和有效性进行确认或验证的过程。国内医疗器械临床试验起步晚,2004 年前一直处于无章可循的窘态。近年来,国内医疗器械临床试验发展迅速,开展数量增长趋势明显,行业格局也发生了一定的变化。国内医疗器械临床试验目前的现状如何?本文就国内医疗器械临床试验目前的现状进行总结和分析。
查看详情
分析与探讨新药与医疗器械临床试验中为受试者提供保险现状,推动新药与医疗器械临床试验为受试者提供保险实施与规范化。方法 调查本院近 2 年的临床试验提供保险的状况。在本院进行的新药与医疗器械临床试验为受试者提供保险除了国外部分国际多中心临床试验外,大多数申办者没有按照国家法规为受试者提供保险,同时由于保险公司的险种制定不完整,出现严重不良事件不能很好鉴定,影响对受试者的赔偿。目前,由于许多新药临床试验没有为受试者提供保险,在试验中发生不良事件后,从而使越来越多的受试者与申办者﹑研究者的纠纷增加,应引起重视。
查看详情
医疗器械是临床诊断和治疗的必要工具,是临床医学研究的重要基础,其在给患者带来预期作用的同时也存在着潜在风险。医疗器械临床试验是新医疗器械研究开发过程中不可或缺的组成部分,直接关系到人体生命与健康。近年来,在我国药物临床试验工作进入成熟模式之后,医疗器械的临床试验工作也开始呈现出持续增长的趋势。医疗器械临床试验作为一个高度专业化的领域,全周期的质量控制对规范其试验的过程与行为,提高试验质量,获得的临床数据真实可靠、科学准确非常重要。
查看详情
2017年5月11—12日,国家食品药品监督管理总局(CFDA)连续发布了关于扶持药品和医疗器械创新的四个征求意见稿,引起了人们对医疗器械和药物临床试验管理改革的关注,本文试就医疗器械临床试验管理展开探讨。医疗器械临床试验管理的现状医疗器械临床试验机构主要是指经过CFDA和国家卫生和计划生育委员会共同认定的承担医疗器械临床试验任务的医疗机构,目前仍与药物临床试验机构绑定在一起。
查看详情
12月12日,医疗产品审评创新研讨会召开,作为2020智慧监管创新大会的一项重要活动,研讨会吸引了众多听众,会议室内座无虚席,站着听讲的听众甚至排到了门外。会议上,政企学研各方代表就医疗器械注册制度创新、智慧审评、真实世界数据研究等热点话题展开了深入讨论。与会专家认为,随着审评审批制度改革的深入推进,诸多政策红利持续释放,推动临床急需医疗器械获批上市,较大程度上满足了人民群众的用械需求。专家同时提醒,审评审批制度改革不仅是监管部门的革新,业界也需要思考和改进,加强对政策法规的理解,建立更高效的政企沟通交流机制,共同推动医疗器械创新,满足临床需求。
查看详情
国家药监局公布上月通过医疗器械产品注册的清单,内含国产三类医疗器械注册、进口二类医疗器械注册、进口三类医疗器械注册及港澳台医疗器械注册,共计121个产品。
查看详情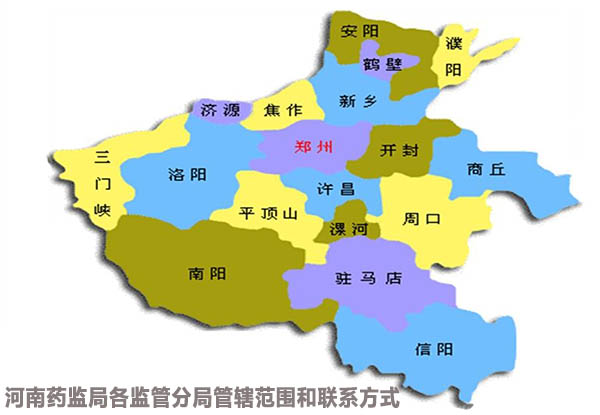
河南省药监局改革正在有序的进行中,从郑州市食品药品监督管理局、洛阳市食品药品监督管理局......逐步向第一监管分局、第二监管分局......转变。目前,河南省药监局已公布九大监管分局管辖范围,暂未给出各监管分局联系方式,飞速度将在官方公布第一时间,将联系方式更新上,敬请期待!
查看详情