24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

从某种程度上来说,前处理对分析测试的结果有着重要的影响。为什么会出现峰值异常?回收率为什么低?为什么柱子经常堵塞?其中很大一部分原因可以归结为样品前处理的不当。
查看详情
1. 软件生命周期过程概述 软件生命周期包括从最初的产品创意到卸载的所有活动。软件生命周期过程包括但不限于以下内容: - 软件开发 - 软件安装和运行 - 软件维
查看详情
在设计开发过程中,器械研发人员经常会遇到许多技术问题,这些问题使他们感到困惑。例如,在确定技术要求时,是否应该包括残留限量要求?在研究化学性能时,如何处理技术要求?在这
查看详情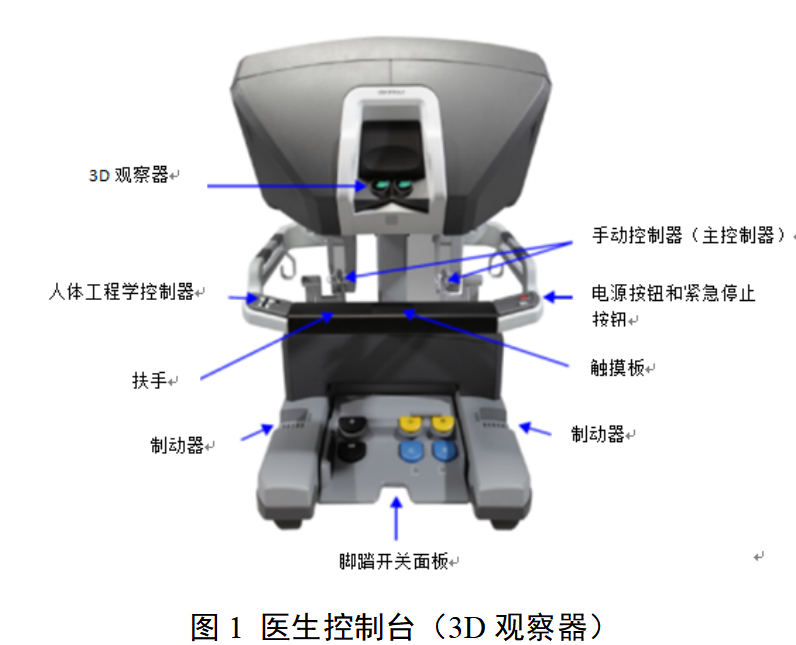
腹腔内窥镜手术系统技术审评要点 (2023年修订版) 本审评要点旨在指导注册申请人对腹腔内窥镜手术系统产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册
查看详情
可重复使用医疗器械再处理的验证方法和标识注册技术审查指导原则(一)(征求意见稿)提出,制造商应向用户提供详细的再处理说明,其中包括清洁方法、清洁剂、冲洗和目视检查等
查看详情
当我们选购日常食品时,会看产品的名称、产地、配料表、生产日期、储存方式,从而判断食品是否含有过多的食品添加剂或者脂肪含量是否过高、哪个产地的生产环境和监管环境更
查看详情
《医疗器械临床试验质量管理规范》共九章66条,章节名称分别是总则、伦理委员会、医疗器械临床试验机构、研究者、申办者、临床试验方案和试验报告、多中心临床试验、记录
查看详情
前言 根据印度《药品和化妆品条例》,原料药需要在印度获得注册证书之后,才可以进行销售或者分销。但是,就原料药如何进行印度注册申报,印度药品管理总局(DCGI)尚未发布相关法
查看详情