24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

3A等级是评级公司给出的最高信用评级,3A等级是指根据标准普尔或穆迪具有最高信用评级的债券或公司。评级公司或者评级机构是指那些为一些公司或个人做出信用评级的机构。他们会将调查结果转卖给和被调查公司有生意来往或者意欲有生意来往的公司。拥有3A信用评级的公司,他们的商业信用往往很好,逾期还款或者拖欠不还的可能性很小。对于其他公司而言,去购买该公司的债券或者以赊销方式提供给该公司服务和货物是比较安全的。相对而言,这样的3A登记公司也会在贷款方面有一定优惠。3A等级是指根据标准普尔或穆迪具有最高信用评级的债券或公司(所谓三A级,因为评级为“AAA”)
查看详情
企业信用不仅是一种资本,一种资源,而且也是一种生产力,如果不把信用建设好,在市场竞争中,很可能会不堪一击。通过信用评级来提高企业信用的透明度,向社会展示企业的诚信品质,树立良好的信用形象,提升企业核心竞争力。企业3a信用等级认证是是企业综合竞争力的证明。信用状况是衡 量企业履约能力、投标信誉的重要因素,通过信用评级 可为企业综合竞争力提供最有力的证明。
查看详情
正规企业信用认证评级机构,服务团队多年代办理经验,规范化办理流程,提供一站式企业3A信用认证服务,高效快捷代办理,提高企业竞争力。
查看详情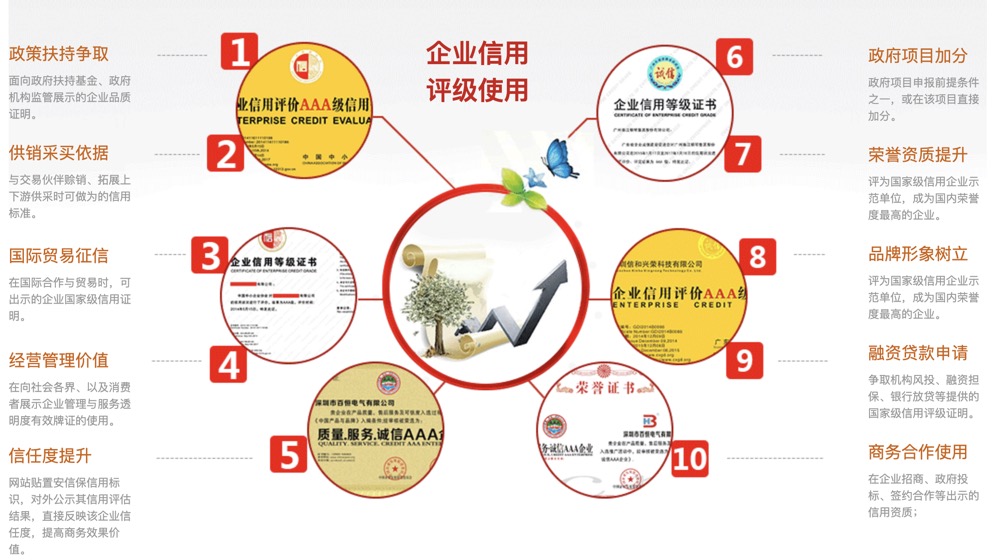
简单概述3A认证办理要求,一起了解一下。
查看详情
企业信用评级是建立社会信用体系的重要内容和基础。 在一种信息不对称的经济环境中,客观、公正的信用评价能够大大降低信息不利一方的合约风险和双方的成本,提高双方的成交意愿。信用评级结果已在企业合作、商品、项目招商、投标招标、、投资等方面得到广泛的应用,部门在行使管理职能时也逐步重视企业信用状况。
查看详情
用评级又称资信评级,是由合法的独立专门从事信用评级的社会中介机构,通过对企业的信用记录及其他综合原因评定出来的综合评价。其中3A等级便是评级公司给出的信用评级,本文讲解3A能给企业带来的好处和应用领域。
查看详情
这几年,随着招投标行业的快速发展,信用监管也变得愈加严格。为响应国家政策的号召,全国各地越来越多的招标方,将企业信用评价结果和资信报告作为投标人资格审查的重要条件。正因如此,越来越多的投标人开始使用第三方机构的信用产品,为自己投标竞标加分。企业信用评级是国家为完善社会信用体系,在全国开展企业行业信用评价的措施,由第三方的信用服务机构,对全国中小企业开展商务信用能力和企业经营综合健康状况进行评价的活动,并以国际通用符号标明信用等级,向参评企业颁发信用等级证书和信用报告,向社会公示评价结果。
查看详情
总体来看,全球医疗器械市场规模呈逐年增长趋势,2019年市场规模近4463亿美元,而中国医疗器械市场整体规模近6259亿元。伴随着人类健康需求的日益增长,医疗卫生事业的不断发展,我国
查看详情