24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
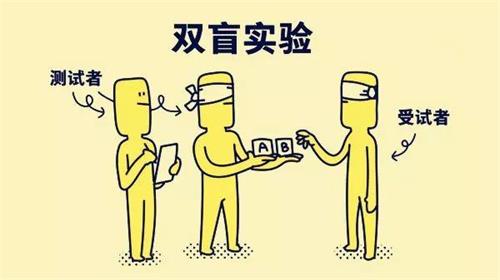
什么是双盲试验?双盲试验是一种更加严格的试验方法,通常适用于以人为研究对象的试验(human subjects),旨在消除可能出现试验者和参与者意识当中的主观偏差(subjective bias)和个人偏好(personal preferences)。在大多数情况下,双盲试验要求达到非常高的科学严格程度。盲态保持的关键,是制定盲态保持计划,明确盲态和非盲人员的职责分工,明确药品的整个管理流程和要求,并且在试验过程中严格遵守相关规定。
查看详情
某同学之前有来问过我关于面试的问题,面了2家之后很快就收到了offer。本篇文章是关于自己面试的一丢丢小心得,从着装到举止言谈,一起看看,希望对你面试有所帮助~

如何做一个研究者喜欢的CRA!大家好,我是壮壮,前段时间,我拜访了一个认识了很久的研究者。久到我刚入行,她还是一枚住院医的时候就天天中午厮混在一起了。遥想当年和申办方斗智斗勇的日子,觉得还是非常开心的。然后今天就有聊到遇到过的一些一言难尽的CRA,然后就“研究者喜欢的CRA”这个话题进行了讨论。
查看详情
“双盲”临床试验中,为保证受试者、研究者不能通过对研究药物的感观获知所使用的具体药物情况,特别制备与研究药物感观相似的但不含试验药物有效成分的模拟剂,这种技术称为“模拟技术”。模拟剂即安慰剂,是仅用于临床研究的一种特殊研究用药,其感观(剂型、形状、颜色、质地)、气味、用法用量,与试验药物完全一致,但不含药物的活性成分。
查看详情
在2020年7月国际标准化组织(ISO)发布了ISO/TR 20416医疗器械 制造商的上市后监督对如何进行上市后监督提供了更详细的指导。特别地,该标准也可以作为满足ISO 13485和ISO 14971要求的方法(见下图)。
查看详情
2021年来了,让我们一起来看看哪些公告机构在2020年获得了MDR/IVDR的资质,你所中意的机构是否在名单中。原本欧盟医疗器械法规的过渡期到2020年5月就结束了,因为全球疫情的原因,该过渡期也被延长了一年。这对生产商来说,又多了一个缓冲,对于很多公告机构来说也是一样。截止2020年12月底,几个主要的医疗器械公告机构都获得了MDR的资质,也有少数公告机构获得了IVDR的资质。
查看详情
我们根据实际案例来看看CRA到底有多辛苦!分享5个情景!仅供娱乐哈哈!!!长时间的苦中作乐,让苦也不觉得苦了。摆正心态,继续迎接苦吧!---送给正在奋斗上进的CRA们
查看详情
今天,小编想跟大家分享一下临床评价资料立卷审查常见问题,在分享问题之前先来了解一下临床评价资料立卷审查要求设定所依据的法规:
《医疗器械注册管理办法》;
《医疗器械说明书和标签管理规定》;
《医疗器械临床试验质量管理规范》;
《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》;
《医疗器械临床评价技术指导原则》;
《接受医疗器械境外临床试验数据技术指导原则》;
《医疗器械临床试验设计指导原则》等。