24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
“双盲”临床试验中,为保证受试者、研究者不能通过对研究药物的感观获知所使用的具体药物情况,特别制备与研究药物感观相似的但不含试验药物有效成分的模拟剂,这种技术称为“模拟技术”。模拟剂即安慰剂,是仅用于临床研究的一种特殊研究用药,其感观(剂型、形状、颜色、质地)、气味、用法用量,与试验药物完全一致,但不含药物的活性成分。
在以安慰剂为对照的临床试验中均采用单模拟技术。另外,即使研究药物与对照药物感观相似但用法用量存在差异,如缓释剂型与常规剂型,也应采用单模拟技术以实现双盲设计。
若临床研究仅需要对一种研究用药设盲(受试者在整个研究期间只使用一种研究用药,或在标准治疗的基础上加用另一研究用药),则仅需要制备该研究用药的安慰剂。因此,顾名思义,单模拟技术是指:申办方仅需制备一种与研究药物所对应的安慰剂。

在以安慰剂为对照的临床研究,不存在两组药物在用法用量上差异,安慰剂组可以完全按照试验药的用法用量。但若药物活性成分带有某种特殊的气味或味道,会导致模拟剂与活性药物在气味/味道、口感上的差异,容易被有经验的研究者或受试者识别,破坏“盲态”的保持。例如:在某评价维生素C缓解感冒症状的临床研究中,采用随机、双盲、安慰剂平行对照设计,疗效评估为基于受试者对自身感冒症状的评估,参与该研究的受试者大部分为医生。由于安慰剂与维生素C在味道上存在差异,导致相当一部分受试者通过味道猜出所接受的是试验药或安慰剂,从而导致安慰剂组脱落率远大于试验组。为此,研究者根据受试者是否自认为猜出所在组别进行分层分析,结果显示:自认为猜出所在组别的受试者人群,维生素C组的疗效明显优于安慰剂组;而那些不知道自己所在组别的受试者,两组疗效差别无统计学意义。
安慰剂与试验药在气味/味道上的异常,也常出现在中成药的临床试验中。上述案例说明,在双盲临床研究,高质量的安慰剂在“双盲维持”中的重要性,换句话说,安慰剂的制备同样需要高技术含量的制剂工艺。
以阳性药为对照的临床研究中,阳性对照药是已上市或其他厂家的产品,其外观、用法用量与试验药很可能完全不一致,若要达到双盲的目的,则需采用双模拟技术,即由申办者制备一个与试验药外观相同的安慰剂,称为试验药的安慰剂;再制备一个与对照药外观相同的安慰剂,称为对照药的安慰剂。试验组的受试者服用试验药加对照药的安慰剂;对照组的受试者则服用对照药加试验药的安慰剂。因此从整个试验用药情况来看,每个入组病例所使用的药物、每日次数、剂量等在外观上或形式上都是一样的,这就保证了双盲法的实施。
假设某试验药物和某阳性对照药物的外观不同、用量不同,则双盲双模拟的给药方案如下图所示
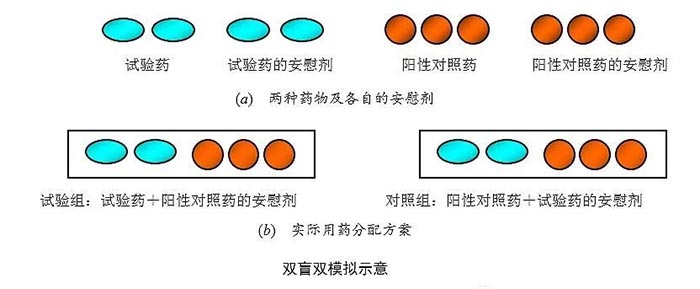
在双盲双模拟的临床试验中,受试者的用药次数与用药量将会增加,可能导致用药依从性的降低。例如:某化学药的Ⅱ期临床研究,总体设计为:多中心、随机、双盲双模拟、两剂量、阳性药平行对照,为同时完成群体药代的研究,受试者知情同意后,进入试验。
该研究的试验药,有两个不同规格:Xmg/片、Ymg/片,2次/天;对照药Zmg/片,2次/天。由于两组药物在外观上存在差异,为保证双盲的实施,采用双模拟技术,分别制备三种不同的模拟剂:试验药Xmg/片模拟剂、试验药Ymg/片模拟剂、对照药模拟剂。所有受试者在研究期间的用药方案为:
一天2次,每次3片:
试验药Xmg组:
1片Xmg+1片Ymg模拟剂+对照药模拟剂
试验药Ymg组:
1片Xmg模拟剂+1片Ymg +对照药模拟剂
对照组Zmg组:
1片Xmg模拟剂+1片Ymg模拟剂+对照药
在研究过程中,部分受试者将参加群体药代的研究,PK参数的测量将导致分组信息的泄露:血药浓度会提示受试者被分入了哪个治疗组,为保持整个研究的“盲态”,需对血样进行编盲,保证PK研究者不能根据血药浓度判断受试者的分组情况。
无论是试验药的安慰剂,还是阳性对照药物的安慰剂,均需通过药品检验部门的检定,保证相应的安慰剂与所模拟的试验药物或对照药物在剂型、外观、溶解度、气味等方面一致。
以上内容节选自陈峰教授和夏结来教授主编的《药物临床试验设计与实施丛书——临床试验统计学》。本书系统介绍了新药、医疗器械临床试验的统计学要求、规范和方法,可用于指导临床试验的设计、管理、资料分析、结果报告等。本书是以国际和我国临床试验生物统计学指导原则为基础,以我国临床试验统计学工作小组全体成员就临床试验统计学的理论、方法、法规、指导原则等诸多方面达成的一系列共识为蓝本,并对共识进行深度解读。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。