24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

在现代医疗领域中,血管介入器械扮演着至关重要的角色,涵盖了血管内导管、导丝和输送系统等多个关键组件。而其中一个颠覆性的创新是涂覆这些器械表面的润滑涂层。这些润滑涂层
查看详情
近期,北京雅果科技有限公司成功研发的“呼吸神经肌肉刺激仪”取得了上市许可。让我们一同与飞速度CRO深入了解呼吸神经肌肉刺激仪在临床前研发阶段所进行的重
查看详情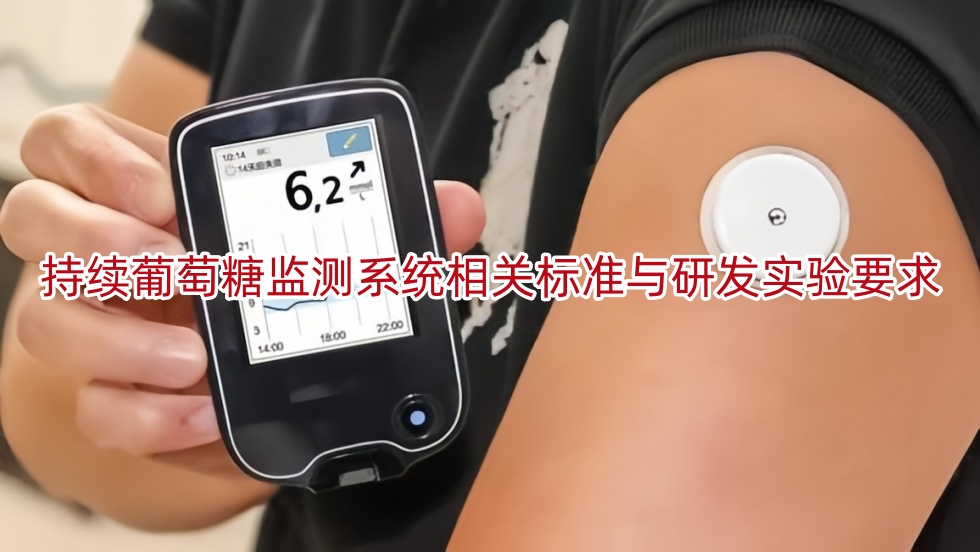
本文适用于有创式持续葡萄糖监测系统。依据《医疗器械分类目录》,申报产品分类编码为07-04-03。按第三类医疗器械管理。一、持续葡萄糖监测系统的结构组成、工作原理和产
查看详情
国家局|通知公告 序号 日期 内容 1 8月1日 医用电子直线加速器获批上市 2 8月2日 2023年7月进口第一类医疗器械产品备案信息
查看详情
医疗器械临床试验质量技术规范
1 范围
本标准涵盖医疗器械上市前临床试验全过程,包括医疗器械临床试验的方案设计、实施、监查、稽 查、检查以及数据的采集、记录、保存、分

体外诊断试剂临床试验质量技术规范
1 范围
本标准定义了对体外诊断(IVD)试剂的临床性能和安全性进行评估而实施的临床试验的方案设计、实施、 监查、稽查、检查以及数据的采

近日,北京济声科技有限公司成功研发的“空间听力计”获得了上市批准。这一创新性产品在临床前研发阶段进行了一系列重要实验,以确保其性能和安全性。让我们与飞
查看详情
医用呼吸道湿化器是一种重要的医用电气设备,它用于湿化并输送呼吸气体给患者。通常,这些设备与各种呼吸治疗设备一起使用,其主要构成包括主机、贮水箱以及一些附件。此外,一些现
查看详情