24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
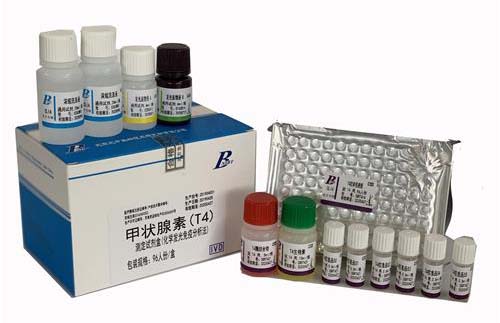
总甲状腺素检测试剂注册技术审查指导原则(2019年第11号)本指导原则旨在指导注册申请人对总甲状腺素检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对总甲状腺素检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情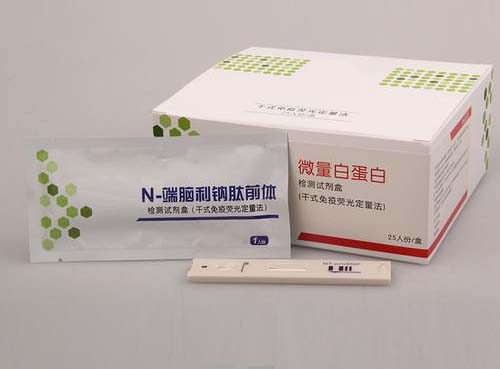
脑利钠肽/氨基末端脑利钠肽前体检测试剂注册技术审查指导原则(2019年第11号)本指导原则旨在指导注册申请人对脑利钠肽/氨基末端脑利钠肽前体检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。本指导原则是对脑利钠肽/氨基末端脑利钠肽前体检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情
为落实国务院关于标准化工作改革决策部署,进一步加强医疗器械标准化工作,国家药监局会同国家标准委起草了《关于进一步加强医疗器械标准化工作的意见(征求意见稿)》,现向社会
查看详情
医疗器械软件注册技术审查指导原则(2015年第50号)本指导原则旨在指导制造商提交医疗器械软件注册申报资料,同时规范医疗器械软件的技术审评要求。本指导原则是对医疗器械软件的一般性要求,制造商应根据医疗器械软件的特性提交注册申报资料,判断指导原则中的具体内容是否适用,不适用内容详述理由。制造商也可采用其他满足法规要求的替代方法,但应提供详尽的研究资料和验证资料。
查看详情
适用于MDR 2017/745法规的下的软件分类应该是困扰大家比较多的事情,今天小编将结合MDCG 2019-11 Qualification and classification of software - Regulation (EU) 2017/745 and Regulation (EU) 2017/746指南为大家说一说,医疗器械软件分类的那些事。
查看详情
目前有3种上市前通知510(k)s可以向FDA提交: 传统(Traditional);特殊(Special); 和 简短(Abbreviated)。“对于确定的、了解清楚的器械种类,基于安全和性能的途径(The Safety and Performance Based Pathway)是简短510(k)途径的一种扩展。在基于安全和性能的途径下,医疗器械制造商可以选择使用FDA认可的有效性标准来证明该器械与进行实质等效比较的器械一样安全有效。使用该途径不会影响FDA通过法规授权获得信息的能力。更多信息,请参阅“基于安全和性能的途径”指导原则。
查看详情
结核分枝杆菌特异性细胞免疫反应检测试剂注册技术审查指导原则(2018年第57号)本指导原则旨在指导注册申请人对结核分枝杆菌特异性细胞免疫反应检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。本指导原则是对结核分枝杆菌特异性细胞免疫反应检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,如不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情
肠道病毒核酸检测试剂注册技术审查指导原则(2018年第36号)本指导原则旨在指导注册申请人对肠道病毒核酸检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是针对肠道病毒核酸检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
查看详情