24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

基于在医疗器械使用者费修正案中的承诺,美国食品药品监督管理局(FDA)正致力于建设一个新的用于审核进度查询平台,即将向医疗器械申请人(以下简称项目申请人)开放。该审核进度查询平台是一个安全的,基于网络的平台,它将以清晰简洁的格式向申请人提供入市申请项目实时的审核状态。目前FDA发布了对该平台的一个简要的描述。
查看详情
国家药监局关于发布《可重复使用医用防护服技术要求》的公告(2020年 第140号)YY/T 1799—2020《可重复使用医用防护服技术要求》医疗器械行业标准已经审定通过,现予以公布。标准编号、名称、适用范围和实施日期见附件。
查看详情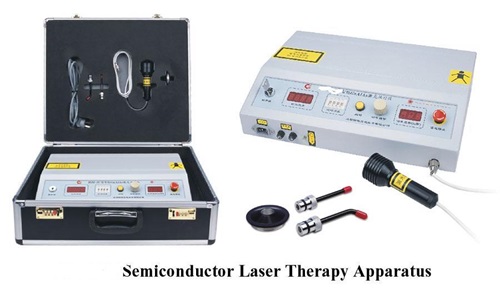
半导体激光治疗机(第二类)注册技术审查指导原则(2017年修订版)(2017年第41号)本指导原则是对半导体激光治疗机(第二类)注册技术审评的通用要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实细化。申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需详细阐述理由,并提供相应的证明资料证明其安全和有效性(包括非临床试验及临床试验等相关资料)。
查看详情
医用电子体温计注册技术审查指导原则(2017年修订版)(2017年第41号)本指导原则旨在指导和规范医用电子体温计类产品的技术审评工作,并为注册申请人提交医用电子体温计产品申报资料提供具体指导。本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
查看详情
本文来自飞速度某客户消融电极产品注册真实案例,目前该产品已成功领取产品注册证书。依据手术电极注册技术审查指导原则(2017年修订版)(2017年第41号)文件,为客户书写的定稿版消融电极产品技术要求。文末提供免费PDF版本下载。
查看详情
手术电极注册技术审查指导原则(2017年修订版)(2017年第41号)本指导原则旨在指导和规范手术电极产品的注册申报工作,帮助注册人员理解和掌握该类产品的原理/机理、结构、主要风险、性能、预期用途等内容,用来指导注册人员准备和撰写申报资料。同时也可以用来帮助审评人员把握技术审评工作基本要求和尺度,对产品安全性、有效性做出系统评价。
查看详情
根据国家食品药品监督总局发布的信息,飞速度技术专门整理了第一类医疗器械产品目录如下: 分类 编码 分类 产品类别 6801 基础外科手术器械 手术刀、组织剪、止血钳、牵开器、刮匙
查看详情
国家药监局发布消息,2020年1月共批准医疗器械注册?产品120个。其中,境内第三类医疗器械产品72个,进口第三类医疗器械产品27个,进口第二类医疗器械注册产品20个,港澳台医疗器械产品1个,详见正文。
查看详情