24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
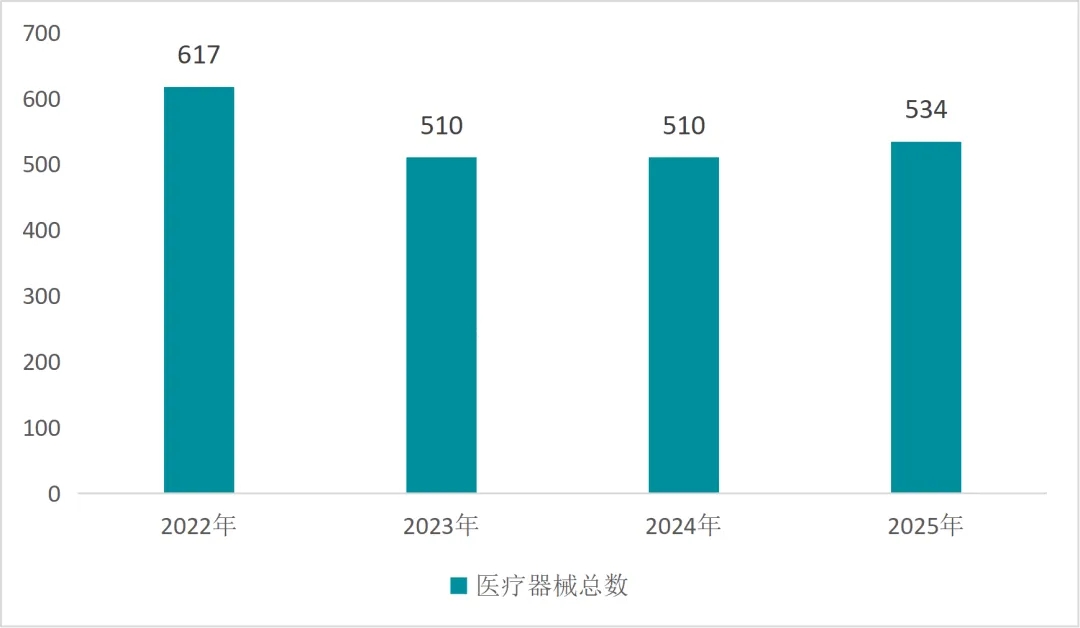
在2025年这个对于中国医疗器械行业而言值得关注的年份里,全年中国医疗器械所获得的FDA认证总量达到534件,该数据相比上一年度呈现出4.7%的微增态势,进而展现出一种温和修复的行业发展状态,虽然这一数据尚未超过2022年617件的历史峰值,但却结束了此前连续两年的企稳状态,从中能够显示出行业正在逐步对出海策略进行调整;而参与FDA认证的企业数量则持续第三年出现下滑情况,从2022年的410家减少至341家,这一变化反映出行业出清加速的趋势;2025年可被称作中国医疗器械出海的“深度调整年”,在全球贸易格局处于重构进程中以及海外合规门槛不断提升的双重背景之下,中国企业的FDA认证表现不仅能够反映出产业竞争力的实际状况,更能够揭示出行业转型的深层逻辑所在。
从产品结构角度进行分析可知在2025年所获批的总数为534件的产品当中II类医疗器械以高达94.4%的占比即504件继续占据着主导地位而I类器械仅有19件未分类器械则有11件,这一格局的形成背后存在着明确的产业逻辑支撑,II类器械因为拥有适中的技术门槛以及稳定的市场需求,所以不仅连续多年稳固地处于FDA获批的核心类目之中,而且其在总获批数量里的占比还呈现出逐年不断攀升的态势,I类器械由于存在相对有限的利润空间,使得企业主动进行投入的意愿一直处于偏低的状态,而III类高风险器械因为受到高技术壁垒以及漫长认证周期的限制,在短期内难以实现突破性的进展。
|
类别 |
数量 |
|
SU普通和整形外科 |
125 |
|
PM物理治疗 |
66 |
|
RA放射 |
58 |
|
GU消化和泌尿 |
54 |
|
CV心血管 |
49 |
|
08妇产 |
41 |
|
DE口腔 |
28 |
|
HO医院综合 |
24 |
|
NE神经 |
21 |
|
AN麻醉 |
18 |
|
EN耳鼻喉科 |
10 |
|
TX毒理 |
9 |
|
CH临床化学 |
8 |
|
OR骨科 |
7 |
|
MI微生物 |
4 |
|
OP眼科 |
1 |
在企业格局层面头部聚集效应随行业发展而愈发显著,其中上海联影医疗科技股份有限公司凭借17件获批产品的数量优势占据榜首位置,而深圳市开颜医疗器械有限公司与深圳童品荟科技有限公司则各自以11件产品获批的相同成绩并列第二,深圳迈瑞生物医疗电子股份有限公司以10件的获批数量紧随其后位列第四;从地域分布的角度进行观察分析,广东省在获得FDA认证的企业数量方面展现出绝对领先优势,有156家企业获得相关认证,该数量占全国总量的45.7%之多,并且是处于第二名位置的江苏省42家企业数量的近四倍之高,由浙江省的37家企业和上海市的17家企业共同构成了第二梯队,与之形成对比的是北方及中西部省份在这方面的企业数量相对较少,这一现状也反映出产业分布不均衡的现象依旧存在于行业之中。
|
省份 |
数量 |
|
广东省 |
156 |
|
江苏省 |
42 |
|
浙江省 |
37 |
|
河北省 |
18 |
|
上海市 |
17 |
|
北京市 |
15 |
|
山东省 |
11 |
|
安徽省 |
9 |
|
湖南省 |
8 |
|
湖北省 |
7 |
|
福建省 |
6 |
|
广西壮族自治区 |
4 |
|
四川省 |
3 |
|
河南省 |
2 |
|
天津市 |
2 |
|
江西省 |
2 |
|
云南省 |
1 |
|
山西省 |
1 |
在认证效率层面所呈现出的情况是,2025年由FDA进行认证的总平均周期时长为144.76天,在这一整体周期当中,II类器械的平均用时处于相对较低的水平,为143.48天,而I类器械的平均用时则相对更高一些,达到了159.21天,II类器械之所以在认证周期方面表现出相对较短的特点,主要是由于企业在申报方面的经验经过长期积累而不断丰富,资料准备的精准程度也有了显著的提升,同时FDA针对常规的II类产品也实施了审查流程的优化措施,此外,头部企业通过采取提前对合规体系进行布局、引入第三方专业机构参与相关工作等方式,对认证周期进行了进一步的压缩,根据美国《联邦食品、药品和化妆品法案》所提出的要求,医疗器械在上市之前必须经历严格的审评程序,中国企业在应对这一程序方面已经积累了数量相当可观且内容丰富的经验。
医疗器械出海作为一项需企业配备强大技术研发能力、构建完善质量管理体系并积累丰富海外合规经验的系统工程,从2025年相关数据能够察觉,中国医疗器械企业正处于从以往单纯注重拼数量、广泛铺赛道的发展模式朝着聚焦强技术、坚守守合规、聚力聚生态的全新发展阶段转变的进程之中,而广东和长三角地区之所以能在这一领域占据领先地位,是因为其具备完善且全面的产业链配套条件、拥有活跃且高效的政企协同创新生态环境,以及获得地方政府精准制定并有效实施的出海扶持政策的有力赋能,这些多重因素共同作用,不仅有效帮助企业降低了在合规方面的成本以及在研发过程中的投入,还进一步促使该领域形成了一种良性的发展循环态势,尽管句子在完整性上可能因复杂结构的构建而有所弱化,但在逻辑复杂程度上通过长句整合、语态转换以及多样修饰语的运用得以显著提升。
展望未来,中国医疗器械产业若想完成从“跟跑”向“领跑”这一具有重大意义的跨越,就必须在高端产品领域实现关键突破,而当前在眼科、微生物等具有高附加值的高端赛道上,相关产品获批数量处于偏少的状态,这种情况充分表明核心技术方面的短板依旧亟待我们去补齐;在全球医疗需求呈现不断增长态势,同时新技术又在快速发展的大背景之下,中国医疗器械企业拥有通过开展持续创新活动以及加强合规建设工作,从而在国际市场之中获取更大发展空间的可能性;值得注意的是,产业实现高质量发展这一目标,并非仅仅依靠企业自身的努力就能够达成,而是需要政策环境、创新生态以及国际合作等多方面因素的共同助力,并且这必然会是一个需要我们长期坚持去推进的复杂过程。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。