24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
医疗器械注册检验是指注册检验为产品的全性能试验,也称为型式检验,第二、三类医疗器械经国家总局认可的医疗检测机构进行注册检验,通过试验所得到的数据或结论验证被测产品是安全、有效的,确认被测产品检测合格后方可临床试验或申请注册。那么,在进行医疗器械注册检验前有哪些工作需要准备呢?对于第一次接触医疗器械注册检验的朋友,以下内容是你不得不了解的。

第一类产品不需要做注册检验(企业自行提供自检报告),第二类、第三类产品均需要做注册检验。
(1)符合国家医疗器械质量管理相关要求生产的样品;
(2)产品技术要求;
(3)产品相关的技术资料。
(1)原则:注册检验应当在具有医疗器械检验资质、且检验项目在其承检范围内的检验机构进行。
(2)选择途径:
Ⅰ、可进入器审中心网站,在右下方活动栏点击"检测中心承检目录库",输入检索产品名称或机构名称,点击"查询"。
Ⅱ、可直接咨询相关医疗器械检验中心。
(1)申请人与检验中心签订检验合同;
(2)申请人提交产品技术要求及产品技术资料,将待检样品送至检验中心;
(3)检验中心开展检测工作;
(4)检验中心出具检测报告。

Ⅰ、检验机构检不了怎么办?
答:尚未列入承检范围的医疗器械,由相应的注册审批部门指定有能力的检验机构进行检验;或申请人可向国家药品监督管理局器械注册司提交由有检验能力的检验机构进行检验的申请,得到批复后,可按批复内容进行。各省药监下属的二级医疗器械检测所承检范围各不相同,可电话询问。目前,中检院检测项目最为广泛,高精尖医疗器械产品注册委托检的首选。委托检需要收取一定的对公费用,检测周期也比注册检要快些。
Ⅱ、申请注册的产品有多个型号怎么办?
答:同一注册单元内所检验的产品应当能够代表本注册单元内其他产品的安全性和有效性。
Ⅲ、送注册检验的样品可以委托生产吗?
答:已通过创新医疗器械特别审批申请的境内医疗器械,样品可委托具有相应生产范围的医疗器械生产企业生产;不属于按照医疗器械特别审批申请的境内医疗器械申请注册时,样品不得委托其他企业生产。
Ⅳ、械注准和械备区别
答:东西是同一个,叫法不同而已。我国医疗器械管理采取备案注册管理制度,其中一类医疗器械采用备案制,二三类采用注册制。看下图就明白了:
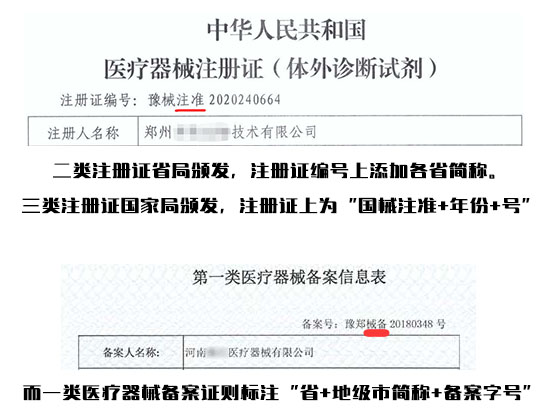
在医疗器械注册申报时,预评价意见应与检验报告一同提交。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。